将 转化为甲醇可以有效利用资源,同时又可控制温室气体,原理为:
转化为甲醇可以有效利用资源,同时又可控制温室气体,原理为:
(1)由下列反应的能量变化,求算制取1mol甲醇放出 KJ。

(2)利用甲醇气体为原料的一种燃料电池,其中一极通空气,电解质为可能过 的钇锆氧化物。电池工作时正极反应 。以该电池为电源,用石墨做电极电解含0.1molCuSO4、0.4molHCl的溶液。一段时间后,当在阴极收集到标况下6.72L气体时,相同条件下(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到气体的物质的量为 mol。
的钇锆氧化物。电池工作时正极反应 。以该电池为电源,用石墨做电极电解含0.1molCuSO4、0.4molHCl的溶液。一段时间后,当在阴极收集到标况下6.72L气体时,相同条件下(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到气体的物质的量为 mol。
(3)甲醇对水质会造成一定的污染,可细菌的作用下,用氨(NH3)处理含甲醇(CH3OH)的工业废水,使其变成无毒的CO2和N2,从而消除对环境的污染,化学方程式为: ,该过程中被氧化的元素是 ,当产生标准状况下2.24L 时,共转移电子 mol。
时,共转移电子 mol。
(1)在层析法分离Fe3+和Cu2+的实验中,层析操作后,滤纸未经氨熏,可观察到滤纸表面有________和________的斑痕。
(2)为使观察效果更明显,实验中采用氨熏显色。请写出Fe3+、Cu2+分别与足量氨水反应的离子方程式_____________________________________________________________
________________________________________________________________________、
________________________________________________________________________。
(3)显色反应结果是滤纸上方颜色呈红棕色,下方呈深蓝色(均在原点之上)说明Fe3+和Cu2+得到了分离。由此可以得出Fe3+和Cu2+在流动相和固定相中的分配情况是
________________________________________________________________________
________________________________________________________________________。
(4)实验中所使用的FeCl3饱和溶液通常会出现浑浊现象,解决的办法是
________________________________________________________________________。
(5)纸层析分离的基本原理是:亲脂性强的成分在流动相中分配的多一些,随流动相移动的速度就快一些;亲水性强的成分在固定相中分配的多一些,随流动相移动的速度就慢一些。请你根据上述实验现象,描述Fe3+和Cu2+得到分离的原因
________________________________________________________________________
________________________________________________________________________。
中国的饮食讲究“色香味”,颜色会影响消费。小李同学拟研发“绿色”食用色素,他以生长很快的入侵植物水葫芦为材料进行如下实验。
Ⅰ.提取叶绿素
Ⅱ.探究pH对叶绿素稳定性的影响
取一些叶绿素粗产品,配成一定浓度的溶液,于室温(约25 ℃)下进行实验,方法和结果如下表。
| 实验组号 |
叶绿素溶液(mL) |
调pH至 |
处理时间(min) |
溶液颜色 |
| ① |
3.0 |
Y |
10 |
绿色 |
| ② |
3.0 |
7.0 |
10 |
绿色 |
| ③ |
3.0 |
6.0 |
10 |
黄绿色 |
| ④ |
3.0 |
5.0 |
10 |
黄褐色 |
注:叶绿素被破坏后变成黄褐色。
根据所学知识和实验结果,请回答:
(1)提取食用叶绿素的X应该为________,原因是
________________________________________________________________________
________________________________________________________________________。
(2)表中Y应该为________,原因是
________________________________________________________________________
________________________________________________________________________。
(3)若用作食品色素,天然叶绿素色素不适用于________食品,否则
________________________________________________________________________。
(4)小李想了解叶绿素粗产品中是否含有其他色素,请你提供检测方法并写出主要步骤。
由环己烷可制得1, 4 – 环己二醇,下列有7步反应(其中无机产物都已略去)。试回答: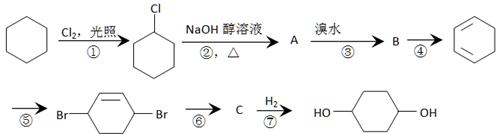
(1) 上述反应(填编号)属于取代反应。
(2) 化合物的结构简式:
B,C;
(3) 反应④所用试剂和条件是;
(4) 写出反应②、⑤的化学方程式:
反应②;
反应⑤。
下面给出了四种烃A、B、C、D的相关信息:
①烃A在所有的烃中含碳的质量分数最低;
②烃B是一种植物生长调节剂,可用于催熟果实;
③烃C在氧气中燃烧产生的氧炔焰常用来切割或焊接金属;
④烃D的分子比例模型如右图所示: 。
。
据此回答有关问题:
(1)将A和Cl2按体积比1:4混合充入一试管,密封后置于光亮处,一段时间后能看到试管内的现象是。
(2)写出把B通入溴的CCl4溶液中的化学方程式;反应类型是。
(3)实验室制取C的化学方程式为;C通入KMnO4 酸性溶液中观察到的现象是,C发生了反应。
(4) D分子中不存在一般的碳碳单键和碳碳双键交替结构,以下能证实这一事实的是。
a.D的邻位二氯取代物不存在同分异构体
b.D的间位二氯取代物不存在同分异构体
c.D的对位二氯取代物不存在同分异构体
下图是维生素A的分子结构:
(1)维生素A中的含氧官能团是(写名称);
(2)维生素A的分子式是 ;
(3)1mol维生素A最多能与mol溴反应;
(4)试指出维生素A可能发生的化学反应类型(任写一种即可)。