(14分)已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍。E有“生物金属”之称,E4+和氩原子的核外电子排布相同。
请回答下列问题:
(1)B、C、D三种元素的电负性由小到大的顺序为____,E的基态原子的电子排布式为 。
(2)由B、D形成的BD32-离子中,其VSEPR模型名称是 ,离子的中心原子采用 杂化。
(3)已知由A、C、D三种元素按照4:2:3的原子个数比可形成某离子化合物,常温下测得该离子化合物的水溶液pH=5,则该溶液中水电离出的氢离子浓度为 。
(4)D、E和钡三种元素构成的某化合物的晶胞结构如图所示,该化合物的化学式为 。纳米级的EO2是一种广泛使用的催化剂,实验室往往通过ECl4在大量水中加热水解制得EO2·xH2O,该反应的化学方程式为 。

(8分)氮元素在生命活动中扮演着十分重要的角色,回答下列与氮及其化合物有关的问题
(1)为了提高农作物的产量,德国化学家哈伯、波施等科学家成功地开发了将氮气转化为氨气的生产工艺。请用化学方程式写出表示工业合成氨的反应原理;
(2)将氨气通入水中可制得氨水,氨水能使无色的酚酞变红。请用电离方程式表示其原因:;
(3)氨气可以跟多种物质发生反应,请将右图实验中有关反应的化学方程式填在横线上(铂作催化剂):、。
利用氧化还原反应原理配平以下化学方程式,并:
FeSO4 + KNO3 + H2SO4 === K2SO4 + Fe2(SO4)3 + NO↑+ H2O
(1)标出电子转移的方向和数目
(2)当电子转移了0.3mol时,有g氧化剂参加反应
下表是某兴趣小组通过实验获得的稀硫酸与某金属反应的实验数据:
| 实验序号 |
金属 质量/g |
金属 状态 |
c(H2SO4) mol/L |
V(H2SO4) mL |
溶液温度/℃ |
金属消失的时间/s |
|
| 反应前 |
反应后 |
||||||
| 1 |
0.10 |
丝 |
0.7 |
50 |
20 |
36 |
250 |
| 2 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
| 3 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
125 |
| 4 |
0.10 |
丝 |
1.0 |
50 |
35 |
50 |
50 |
分析上述数据,回答下列问题:
(1)上述反应中,反应物的总能量比生成物的总能量(选填“高”、“低”或“相等”)。
(2)实验1、2可得出的结论是;
实验3、4可得出的结论是。
(3)若将该金属与铁用导线连接,插入盛有稀硫酸的烧杯中制作成原电池,观察到铁的表面有大量气泡。该金属的金属活动性比铁(选填“强”或“弱”),铁电极上发生的电极反应式为。
下表为元素周期表的一部分,请参照①~⑩在表中的位置,用化学用语回答下列问题:
(1)元素③形成的单质的电子式为;元素②形成的最高价氧化物的结构式为。
(2)⑥、⑦两元素的最高价氧化物的水化物之间反应的离子方程式为。
(3)②、③、④、⑤元素形成的氢化物中,热稳定性最强的是(填化学式),沸点最高的是(填化学式)。
(4)⑧、⑨元素的最高价氧化物的水化物酸性强弱比较>(填化学式)。
(5)用电子式表示⑥、⑧两元素结合成化合物的形成过程。
(6)元素⑩在周期表中的位置;该元素的单质主要用途(填一种)。
从海水中可以获得淡水、食盐并可提取镁和溴等物质。
(1)海水淡化的方法主要有(填一种)。
(2)经过化学变化才能从海水中获得的物质是(填序号)
| A.氯、溴、碘 | B.钠、镁、铝 | C.烧碱、氢气 | D.食盐、淡水 |
(3)从海水中提取镁的流程如下图所示: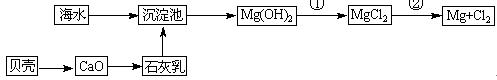
反应①的离子方程式为。
反应②的化学方程式为。
(4)从海水中提取溴的主要步骤是向浓缩的海水中通入氯气,将溴离子氧化,该反应的离子方程式为。