NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol·L-1 NaHSO3(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断不正确的是
| A.40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 |
| B.图中b、c两点对应的NaHSO3反应速率相等 |
| C.图中a点对应的NaHSO3反应速率为5.0×10-5mol·L-1·s-1 |
| D.温度高于40℃时,淀粉不宜用作该试验的指示剂 |
一定条件下,硝酸铵受热分解的未配平化学方程式为:NH4NO3 HNO3+N2+H2O。在反应中被氧化与被还原的氮原子数之比为( )
HNO3+N2+H2O。在反应中被氧化与被还原的氮原子数之比为( )
| A.5∶3 | B.5∶4 | C.1∶1 | D.3∶5 |
在2KMnO4+16HCl====2KCl+2MnCl2+5Cl2↑+8H2O反应中( )
| A.氧化产物与还原产物粒子个数比是2∶5 |
| B.被氧化的盐酸占参加反应盐酸总数的5/8 |
| C.KMnO4只有一部分发生还原反应 |
| D.KMnO4与HCl恰好分别完全发生还原反应和氧化反应 |
在氧化还原反应3S+6KOH====K2SO3+2K2S+3H2O中,被氧化与被还原的硫原子数之比为( )
| A.1∶2 | B.2∶1 | C.1∶1 | D.3∶2 |
根据下列反应判断有关物质还原性由强到弱的顺序是( )
①H2SO3+I2+H2O====2HI+H2SO4
②2FeCl3+2HI====2FeCl2+I2+2HCl
③3FeCl2+4HNO3====2FeCl3+NO↑+2H2O+Fe(NO3)3
| A.H2SO3>I->Fe2+>NO | B.I->Fe2+>H2SO3>NO |
| C.Fe2+>I->H2SO3>NO | D.NO>Fe2+>H2SO3>I- |
下列反应需要加入氧化剂才能实现的是…()
| A.Cl2→Cl- | B.H+→H2 | C.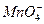 →Mn2+ →Mn2+ |
D.Zn→Zn2+ |