室温时,向20 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生,且混合溶液的体积可看成混合前两溶液的体积之和),下列说法不正确的是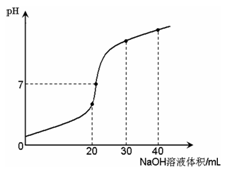
| A.pH=7时,溶液中c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| B.当V(NaOH)=20mL时,溶液中水的电离程度比纯水大 |
| C.当V(NaOH)=30mL时,溶液中 c(SO42-)+ c(H+)=c(NH3·H2O) + c(OH-) |
| D.滴加NaOH溶液从30mL至40mL,溶液中Na+与SO42-浓度之和始终为0.1 mol·L-1 |
用下列装置能达到实验目的是
将0.5 mol SO2和0.2 mol O2置于密闭容器中发生反应:2SO2+O2 2SO3。下列关于该反应的说法正确的是
2SO3。下列关于该反应的说法正确的是
| A.最终可生成0.4 mol SO3 | B.当v正(O2)= v逆(SO2) = 0时一定达化学平衡 |
| C.升高温度反应速率减小 | D.缩小体积增大压强反应速率增大 |
下列关于糖类、油脂、蛋白质的说法正确的是
A.大多数能在一定条件下发生水解反应
B.都是天然高分子化合物
C.组成元素均为C、H、O
D.蛋白质遇饱和硫酸铵溶液会凝聚,失去生理功能
关于化学反应与能量的说法正确的是
| A.燃烧属于放热反应 | B.中和反应是吸热反应 |
| C.形成化学键时吸收能量 | D.反应物总能量与生成物总能量一定相等 |
下列反应的离子方程式正确的是
| A.氢氧化镁和稀硫酸的反应:Mg(OH)2+2H+=2H2O+Mg2+ |
| B.二氧化硫与氢氧化钠溶液的反应SO2+2OHˉ= SO42ˉ+H2O |
| C.钠和硫酸铜溶液的反应:2Na+Cu2+=2Na++Cu |
| D.碳酸钙和醋酸的反应:CaCO3 +2H+=Ca2++H2O+CO2 |