【原创】X、Y、Z是由1-18号元素组成的物质,它们之间存在如下转化关系。
X + H2O →Y + Z
(1)上述反应为氧化还原反应。
①若X和Y是同主族元素组成的单质,且组成X的元素位于第三周期,此反应的离子方程式是 。
②若Y和Z都可在一定条件下还原CuO,则此反应的化学方程式是 。
(2)上述反应为非氧化还原反应。
①若X是一种钠盐,Z为两性氢氧化物,则甲X的化学式为 ,Z的酸式电离方程式为 。
②若X是由N和Cl元素组成的化合物,其分子结构模型类似于氨气的结构模型,Y具有漂白性。则甲中Cl元素的化合价是 ,Z与H2O有相同的电子总数,则Z的电子式为 。
[物质结构与性质]磷化硼是一种高折射率红棕色晶体,可通过单质B与Zn3P2(或PH3)反应,也可热解PCl3·BCl3制得。
(1)锌离子基态时核外电子排布式为。
(2)PH3中磷原子的杂化轨道类型为,BCl3空间形状为(用文字描述)。
(3)PCl3能够与配合物Ni(CO)4发生配体置换反应:Ni(CO)4 +4PCl3 = Ni(PCl3)4 +4CO。
①与CO互为等电子体且带1个单位负电荷的阴离子化学式为。
②1molNi(PCl3)4中含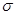 键数目为。
键数目为。
(4)立方BP的晶胞结构如图所示,晶胞中含B原子数目为。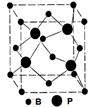
磺酰氯(SO2Cl2)是一种有机氯化剂,也是锂电池正极活性物质。已知磺酰氯是一种无色液体,熔点-54.1℃,沸点69.1℃,遇水发生剧烈水解。
(1)已知:①SO2 (g) +Cl2 (g)+ SCl2 (g) 2SOCl2 (g)△H="a" kJ·mol-1
2SOCl2 (g)△H="a" kJ·mol-1
②SO2Cl2(g)+ SCl2 (g)  2SOCl2(g) △H="b" kJ·mol-1
2SOCl2(g) △H="b" kJ·mol-1
则反应:SO2(g) + Cl2(g) SO2Cl2(g) △H =kJ·mol-1(用含a、b的代数式表示);该反应平衡常数表达式为K =。
SO2Cl2(g) △H =kJ·mol-1(用含a、b的代数式表示);该反应平衡常数表达式为K =。
(2)磺酰氯可与白磷发生反应为:P4+ 10SO2Cl2= 4PCl5 + 10SO2↑,若生成1molSO2,则转移电子的物质的量为mol。
(3)某学习小组的同学依据反应:SO2(g)+ Cl2(g) SO2Cl2(g) △H <0,设计的制备磺酰氯装置如图-1。
SO2Cl2(g) △H <0,设计的制备磺酰氯装置如图-1。
①若用浓盐酸与二氧化锰为原料制取Cl2,其反应的化学方程式为。
②有关图-1所示的装置说法正确的是(不定项选择)。
a.A、E处洗气瓶中盛放的可能分别是饱和食盐水和饱和NaHSO3溶液
b.B处反应管内五球中玻璃棉上的活性炭作催化剂
c.B处反应管冷却水应从m接口通入
d.装置C处吸滤瓶应放在冰水中冷却
e.D处U形管中盛放的可能是碱石灰
③从化学平衡移动角度分析,反应管通水冷却的目的为。
(4)GET公司开发的Li-SO2Cl2军用电池,其示意图如图-2所示,已知电池反应为:2Li + SO2Cl2 =" 2LiCl" + SO2↑;则电池工作时,正极的电极反应式为。
某合作学习小组的同学拟用硼砂制取硼酸并测定硼酸样品的纯度。制备硼酸的实验流程如下:
(1)溶解硼砂时需要的玻璃仪器有:烧杯和。
(2)用pH试纸测定溶液pH的操作方法为。
(3)用盐酸酸化硼砂溶液生成硼酸的离子方程式为。
(4)实验流程中缺少的步骤a、步骤b操作分别为、。
(5)硼酸酸性太弱不能用碱的标准溶液直接滴定,实验室常采用间接滴定法,其原理为:
滴定步骤为:
①定到终点时溶液颜色变化是。
②若滴定到终点时消耗NaOH标准溶液22.00mL,则本次滴定测得的硼酸样品中硼酸的质量分数为(假定杂质不反应)。
③若滴定时滴定管尖嘴部分有气泡,滴定过程中消失,将导致测得的结果(选填:“偏大”、“偏小”或“不变”)。
Co2(OH)2CO3和Co(CH3COO)2·nH2O均是生产高比能锂电池正极材料的前驱体。
(1)这两种钴的化合物中钴的化合价为。
(2)Co2(OH)2CO3在空气中充分加热生成四氧化三钴,该反应的化学方程式为。
(3)为确定Co(CH3COO)2·nH2O中的n值及其热分解过程,取一定量的样品在氮气氛围中加热,样品的固体残留率( )随温度的变化如下图所示(样品在300℃前失去结晶水,图中A、B、C、D各处固体均为纯净物,其中C、D为氧化物)。
)随温度的变化如下图所示(样品在300℃前失去结晶水,图中A、B、C、D各处固体均为纯净物,其中C、D为氧化物)。
①Co(CH3COO)2·nH2O晶体中n=(填自然数)。
②A→B点反应释放的气体为纯净物(由两种元素组成),该气体的结构简式为。
③B→C点反应释放CO、CO2两种气体,n(CO)∶n(CO2)=。
④D点残留固体的化学式为。(列出上述计算过程)
长托宁是一种选择性抗胆碱药,可通过以下方法合成(部分反应条件略去):
(1)长托宁中的含氧官能团为_________和_________(填名称)
(2)反应②中加入试剂X的分子式为C8H6O3 ,X的结构简式为_________
(3)反应③的反应类型为_______________
(4)S的同分异构体满足下列条件:
①.能与FeCl3溶液发生显色反应。
②.核磁共振氢谱有5个峰且峰的面积比为2:4:4:1:1;分子中含有两个苯环。写出该同分异构体的结构简式_________________
(5)根据已有知识并结合相关信息,写出以 和
和 为原料制备
为原料制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下: