【改编】氨气在科研、生产中有广泛应用。
(1)在三个1L的恒容密闭容器中,分别加入0.1mol N2和0.3mol H2发生反应N2(g)+3H2(g) 2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。
2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。

①实验Ⅲ在前10分钟内NH3平均反应速率v(NH3)= ;
②与实验Ⅱ相比,实验Ⅲ采用的实验条件可能为 。
③K(T1)___K(T2)(填“>”、“=”或“<”)。
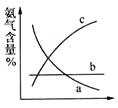
④下图表示随条件改变,平衡体系中氨气体积分数的变化趋势。当横坐标为压强时,变化趋势正确的是(填序号,下同)__________,当横坐标为温度时,变化趋势正确的是___________。
(2)常温下NH3•H2O的电离平衡常数Kb=1.8×10-5 mol·L-1,则反应NH4+(aq)+H2O(l) NH3•H2O(aq)+H+(aq)的化学平衡常数Kh= (保留三位有效数字)。
NH3•H2O(aq)+H+(aq)的化学平衡常数Kh= (保留三位有效数字)。
(3)工业上用NH3消除NO污染。在一定条件下,已知每还原1molNO,放出热量120kJ,请完成下列热化学方程式: NO(g)+ NH3(g)= N2(g)+ (g) ΔH2= 。
(NH4)2Fe(SO4)2俗称莫尔盐,其常见的制备工艺流程如下:
(1)已知流程中铁粉制备反应如下:
4 H2O(g) +3Fe(s) Fe3O4(s)十4H2(g) △H ="a" kJ /mol
Fe3O4(s)十4H2(g) △H ="a" kJ /mol
Fe3O4(s) =" 3" Fe(s)+ 2O2(g) △H ="b" kJ/mol
则光解气态水制备H2的热化学方程式为。
(2)步骤I中加水发生如下反应,请完善该反应:+2H2O  2H++ H2TiO3 ↓;
2H++ H2TiO3 ↓;
该步骤加入铁粉的作用是①;②。
(3)步骤Ⅳ生成(NH4)2Fe(SO4)2,其化学反应方程式为;
写出(NH4)2Fe(SO4)2溶液中各离子溶度由大到小的顺序:
(4)已知在潮湿空气中Fe(OH)2比FeCl2更易被氧化。据此分析(NH4)2Fe(SO4)2比FeSO4稳定的原因是。
(5)室温时Fe(OH)3的悬浊液中存在Fe(OH)3(s) Fe3+(aq)+3OH-(aq) Ksp[Fe(OH)3] =8ⅹ10-32若此悬浊液中 c(Fe3+)="0.08" mol·L-1则溶液的pH等于。
Fe3+(aq)+3OH-(aq) Ksp[Fe(OH)3] =8ⅹ10-32若此悬浊液中 c(Fe3+)="0.08" mol·L-1则溶液的pH等于。
1902年德国化学家哈博研究出合成氨的方法,其反应原理为:
N2(g)+3H2(g) 2NH3(g);△H(△H<0)
2NH3(g);△H(△H<0)
一种工业合成氨的简易流程图如下:
完成下列填空:
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生。NH4HS的电子式是___________,写出再生反应的化学方程式:__________________。NH3的沸点高于H2S,是因为NH3分子之间存在着一种比_________力更强的作用力。
(2)室温下,0.1 mol/L的氯化铵溶液和0.1 mol/L的硫酸氢铵溶液,酸性更强的是_______,其原因是___________________________________________________________。
已知:H2SO4:H2SO4 = H++HSO4-;
HSO4- H++SO42- :
H++SO42- :
K =1.2×10-2NH3·H2O:K=1.8×10-5
(3)图甲表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:______(保留3位有效数字)。
(4)依据温度对合成氨反应的影响,在图乙坐标系中,画出一定条件下的密闭容器内,从常温下通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。

(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。
简述本流程中提高合成氨原料总转化率的方法(只答一种即可):_________________。
【化学—选修2:化学与技术】重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产它,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。涉及的主要反应是6FeO·Cr2O3+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O
(1)碱浸前将铬铁矿粉碎的作用是。
(2)步骤③调节pH后过滤得到的滤渣是。
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式。
(4)用简要的文字说明操作⑤加入KC1的原因。
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL于碘量瓶中,加入10mL 2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I一十S4O52-)
①判断达到滴定终点的依据是。
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为(设整个过程中其它杂质不参加反应)(保留2位有效数字)。
二氧化碳被认为是加剧温室效应的主要来源。2014年11月12日中美两国在北
京发表《中美气候变化联合声明》,中国政府承诺到2030年前停止增加二氧化碳排放,
为此政府大力推广二氧化碳的综合开发和利用。以CO2和NH3为原料合成尿素是固定和
利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g) NH2CO2NH4(s) △H1 =" a" kJ·mol-1
NH2CO2NH4(s) △H1 =" a" kJ·mol-1
反应Ⅱ:NH2CO2NH4(s) CO(NH2)2(s)+H2O(g) △H2 =+72.49kJ·mol-1
CO(NH2)2(s)+H2O(g) △H2 =+72.49kJ·mol-1
总反应Ⅲ:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) △H3 =-86.98kJ·mol-1
CO(NH2)2(s)+H2O(g) △H3 =-86.98kJ·mol-1
请回答下列问题:
(1)反应Ⅰ的△H1 =__________kJ·mol-1(用具体数据表示)。
(2)反应Ⅲ中影响CO2平衡转化率的因素很多,图1为某特定条件下,不同水碳比n(H2O)/n(CO2)和温度影响CO2平衡转化率变化的趋势曲线。
①其他条件相同时,为提高CO2的平衡转化率,生产中可以采取的措施是_________(填“提高”或“降低”)水碳比。
②当温度高于190℃后,CO2平衡转化率出现如图1所示的变化趋势,其原因是__________________。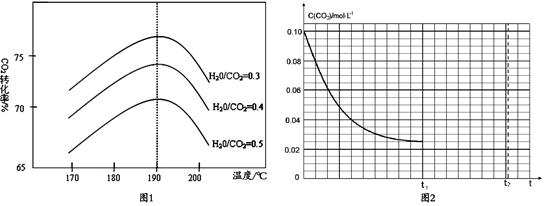
(3)反应Ⅰ的平衡常数表达式K1 =____________________。
(4)某研究小组为探究反应Ⅰ中影响c(CO2)的因素,在恒温下将0.4molNH3和0.2molCO2放入容积为2L的密闭容器中,从反应开始到达到平衡过程中c(CO2)随时间t变化趋势的曲线如图2所示。若其他条件不变,t1时将容器体积压缩到1L,请画出t1后c(CO2)随时间t变化趋势曲线(t2达到新的平衡)。
(5)尿素在土壤中会发生反应CO(NH2)2+2H2O (NH4)2CO3。下列物质中与尿素有类似性质的是______。
(NH4)2CO3。下列物质中与尿素有类似性质的是______。
| A.NH2COONH4 |
| B.H2NOCCH2CH2CONH2 |
| C.HOCH2CH2OH |
| D.HOCH2CH2NH2 |
(6)人工肾脏可用间接电化学方法除去代谢产物中的尿素,原理如图3。阳极室中发生的反应为、。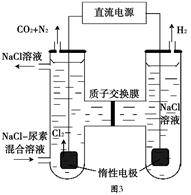
某工业废玻璃粉末含SiO2、Fe2O3、CeO2、FeO等。某课题小组设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵矾。
已知:CeO2不溶于稀硫酸;酸性条件下,Ce3+易水解,Ce4+有较强氧化性。
(1)硫酸铁铵矾可净水,其原理是(写离子方程式)。
(2)滤液A的主要成分(填写化学式)。
(3)反应①的离子方程式是。
(4)反应②的化学反应方程式是。
(5)已知制硫酸铁铵矾晶体[Fe2(SO4) 3·(NH4) 2SO4·24H2O,式量964]的产率为80%,若加入13.2g (NH4) 2SO4(式量132),可制得晶体的质量是。
(6)化合物HT可作为萃取剂能将铈离子从水溶液中萃取出来,过程表示为:
Ce2(SO4)3 (水层)+ 6HT(有机层) 2CeT3 (有机层)+3H2SO4(水层)
2CeT3 (有机层)+3H2SO4(水层)
分液得到CeT3 (有机层),再加入H2SO4 获得较纯的含Ce3+的水溶液。可选择硫酸作反萃取剂的原因是(从平衡移动角度回答)。