某小组进行铝热反应实验,装置如图所示。
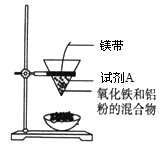
(1)铝热反应原理 (写化学方程式),试剂A为 (写化学式)。
(2)对坩埚内的黑色固体物质的组成,小组进行了如下探究
假设I:该黑色物质为铁
假设Ⅱ:该黑色物质为铁与氧化铁的混合物
【设计方案并实验】
| 实 验 步 骤 |
现 象 |
结 论 |
| ①取少量黑色固体于试管中加稀盐酸 |
固体全部溶解,有气泡产生 |
假设I成立, 假设Ⅱ不成立 |
| ②滴入几滴0.01mol/LKSCN溶液 |
溶液不变色 |
【交流评价】
你认为上述结论是否合理? ,理由是 。
(3)取上述实验所得溶液,滴入适量氯水溶液变红色。
①此时涉及的氧化还原反应的离子反应方程式为 。
②利用反应体系中存在的平衡:Fe3++3SCN— Fe(SCN)3,小组再将滴入适量氯水的溶液平均分成两份,分别置于两支试管中并编号l、2,进行如下表所示的探究。该实验中,小组主要探究的问题是 ;应重点观察的现象是 ;预计得出的结论是 。
Fe(SCN)3,小组再将滴入适量氯水的溶液平均分成两份,分别置于两支试管中并编号l、2,进行如下表所示的探究。该实验中,小组主要探究的问题是 ;应重点观察的现象是 ;预计得出的结论是 。
| 实验编号 |
实验步骤 |
| 1 |
①滴加饱和FeCl3溶液4滴,充分振荡 |
| ②滴加几滴NaOH溶液 |
|
| 2 |
①滴加4滴1mol/LKSCN溶液 |
| ②滴加几滴NaOH溶液 |
工业生产纯械的工艺流程示意图如下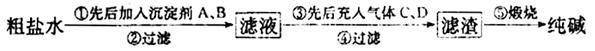
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(A来源于石灰窑厂),则B的化学式_________。
(2)②过滤后滤液中要通入C和D气体,则先通入的C气体是_________(填化学式),原因是_________。
(3)通入C和D气体后发生反应的化学方程式是_________。
(4)④过滤后,向滤液中通氨气,加入细小食盐颗粒,析出副产品________ (填写化学式),通氨气与加入细小食盐颗粒的作用是_________。
(5)写出⑤锻烧发生反应的化学方程式_________。产品纯碱中含有碳酸氢钠,若用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质童分数ω(NaHCO3)= _________ (注明表达式中所用的有关符号的含义)。
氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2 • 2H2O)。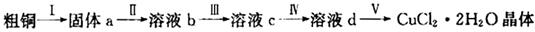
(1)为了完成步骤I,可采用如下图所示的装置将粗铜转化为固体a。
在该实验中,加热A、C装置中的酒精灯时,应该先点燃_______装置的酒精灯,D装置的作用是
_______,C装置中生成的产物是_______。
(2)步骤II中的操作是:将步骤I中的固体加入到容器中,然后加入_______,固体完全溶解。
(3)步骤III中加入的试剂是H2O2,其目的是提高最终制备的氯化铜晶体的纯度,试写出有关反应的离子方程式______________。
(4) 步骤IV中应先加入某试剂,然后过滤得到滤液。为了调节溶液的pH只使Fe3+完全沉淀,加入的试剂是CuO粉末而不用氨水或NaOH溶液,其理由是_______。
(5)步骤V中,将溶液蒸发浓缩、冷却结晶、过滤得到CuCl2·2H2O晶体。现欲得到无水CuCl2,在实验室也可以采用上述装置完成CuCl2 • 2H2O脱水得到无水CuCl2,则A装置中的两种化学试剂是_____。
某Na2CO3样品中混有一定量的Na2SO4 (设均不含结晶水),某化学兴趣小组采用两种方案测定该样品中Na2CO3的质量分数,试回答下列问题。
方案一:利用下列方案完成Na2CO3质量分数的測定
(1)操作③和④的名称分别为_______。
(2)上述操作①~④中,使用到玻璃棒的有______(填操作序号)。
(3)判断操作②否完成的方法是______
方案二:采用下图实验装置(夹持仪器已省略).选用下列试剂: a.浓硫酸b.饱和NaHCO3溶液C.6mol/L盐酸D.2mol/L硫酸, e.碱石灰f. 无水CaCl2,測定样品中Na2CO3,的质量分数:
(4)填写表中空格:
| 仪器 |
试剂 |
加入该试剂的目的 |
| A |
鼓入空气时洗去CO2 |
|
| B |
使样品充分反应放出气体 |
|
| C |
a |
|
| D |
e |
充分吸收CO2 |
| E |
e |
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
A B C
Ⅰ.铁矿石中含氧量的测定
① 按上图组装仪器,检查装置的气密性;
② 将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
③ 从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯
④ 充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)装置C的作用为。
(2)测的反应后装置B增重1.35g,则铁矿石中氧的百分含量为。
Ⅱ.铁矿石中含铁量的测定
(1)步骤④中煮沸的作用是。
(2)步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、。
(3)下列有关步骤⑥的操作中说法正确的是。
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测液润洗
e.滴定过程中,眼睛注视滴定管中液面变化
f.滴定结束后,30s内溶液不恢复原来的颜色再读数
(4)若滴定过程中消耗0.5000mol·L−1KI溶液20.00mL,则铁矿石中铁的百分含量为。
Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为。
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。
已知:①氧化性: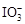 >Fe3+>I2;还原性:
>Fe3+>I2;还原性: >I-;②KI+I2
>I-;②KI+I2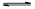 KI3
KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为4份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①向第四份试液中加K3Fe(CN)6溶液,根据是否得到具有特征蓝色的沉淀,可检验是否含有(用离子符号表示),蓝色的沉淀是_______(用化学式表示)。
②第二份试液中加入足量KI固体后,反应的离子方程式为:______、______
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失写出潮湿环境下KI与氧气反应的化学方程式:_________________。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质不适合作为食盐加碘剂,其理由是_________________________________。
(3)某同学为探究温度和反应物浓度对反应2IO3-+5SO32-+2H+=I2+5SO42-+H2O的速率的影响,设计实验如下表所示:
| 0.01mol·L-1KIO3 酸性溶液(含淀粉) 的体积/mL |
0.01mol·L-Na2SO3 溶液的体积/mL |
H2O的 体积/mL |
实验 温度 /℃ |
溶液出现 蓝色时所 需时间/s |
|
| 实验1 |
5 |
V1 |
35 |
25 |
t1 |
| 实验2 |
5 |
5 |
40 |
25 |
t2 |
| 实验3 |
5 |
5 |
V2 |
0 |
t3 |
表中数据:t1t2(填“>”、“<”或“=”);表中V2=___________mL