草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O。现用H2C2O4进行如下实验:
(一)探究草酸的不稳定性
通过如图实验装置验证草酸受热分解产物中的CO2和CO,A、B、C中所加入的试剂分别是:

A、乙醇 B、 C、NaOH溶液。
(1)B中盛装的试剂 (填化学式)
(2)A中加入乙醇的目的是 。
(二)探究草酸的酸性
将0.01mol草酸晶体(H2C2O4·2H2O)加入到100ml 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈碱性,其原因是 (用离子方程式表示)。
(三)用酸性KMnO4溶液与H2C2O4溶液反应来探究影响化学反应速率的因素
I、实验前先用酸性KMnO4标准溶液滴定未知浓度的草酸
反应原理: MnO4- + H2C2O4+ = Mn2+ + CO2↑+ H2O
(1)配平上述离子方程式。
(2)滴定时KMnO4溶液应盛装于 (填 “酸式”或“碱式”)滴定管中。
Ⅱ、探究影响化学反应速率的因素
| 实验 组别 |
c(H2C2O4) /(mol/L) |
V(H2C2O4) /ml |
c(KMnO4) /(mol/L) |
V(KMnO4) /ml |
c(H2SO4) /(mol/L) |
褪色所需时间 |
实验 目的 |
| 1 |
0.2 |
2 |
0.0025 |
4 |
0.12 |
6'55'' |
(a) |
| 0.2 |
2 |
0.005 |
4 |
0.12 |
5'17'' |
||
| 0.2 |
2 |
0.01 |
4 |
0.12 |
3'20'' |
||
| 0.2 |
2 |
0.02 |
4 |
0.12 |
9'05'' |
||
| 0.2 |
2 |
0.03 |
4 |
0.12 |
11'33'' |
||
| 0.2 |
2 |
0.04 |
4 |
0.12 |
14'20'' |
下表列出了在“探究影响化学反应速率的因素”实验中得出的部分实验数据:
请回答:
(1)实验目的(a)是 ;
(2)根据表中数据在坐标中画出反应褪色所需时间随KMnO4溶液浓度的变化关系图像;

(3)若要探究催化剂对该反应速率的影响应选择MnSO4而不选MnCl2作为催化剂,其原因是 。
下图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。
(1)若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为 (填代号)。能验证CO氧化产物的现象是 。
(2)停止CO和CO2混合气体的通入,E内放置Na2O2,按A→E→D→B→H装置顺序制取纯净干燥的O2,并用O2氧化乙醇。此时,活塞a应 ,活塞b应 ,需要加热的仪器装置有 (填代号),m中反应的化学方程式为: 。
(3)若气体入口改通空气,分液漏斗内改加浓氨水,圆底烧瓶内改加NaOH固体,E内放置铂铑合金网,按A→G→E→D装置顺序制取干燥的氨气,并验证氨的某些性质。
①装置A中能产生氨气的原因有 。
②实验中观察到E内有红棕色气体出现,证明氨气具有 性。
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。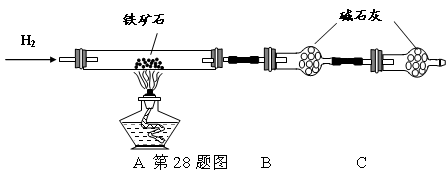
Ⅰ.铁矿石中含氧量的测定;
① 按上图组装仪器,检查装置的气密性;
② 将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品都为碱石灰(详见图示,夹持仪器省略)
③ 从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯
④ 充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)装置C的作用为 。
(2)测的反应后装置B增重1.35g,则铁矿石中氧的百分含量为 。
Ⅱ.铁矿石中含铁量的测定
(3)步骤④中煮沸的作用是 。
(4)步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、 。
(5)下列有关步骤⑥的操作中说法正确的是 。
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测液润洗
e.滴定过程中,眼睛注视滴定管中液面变化
f.滴定结束后,30s内溶液不恢复原来的颜色再读数
(6)若滴定过程中消耗0.4000mol·L−1KI溶液25.00ml,则铁矿石中铁的百分含量为 。
Ⅲ.(7)由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为 。
邻叔丁基对苯二酚(TBHQ) 是一种新颖的食品抗氧剂,其制备原理为:
实验过程中的主要步骤如下:
步骤1.向三口烧瓶中加入5.5g对苯二酚,5.OmL浓磷酸及20mL二甲苯(装置如图所示),启动搅拌器。
步骤2.缓缓加热到100-110°C,慢慢滴加7.5mL叔丁醇和5mL二甲苯组成的溶液,30-60min内滴完。
步骤3.升温到135-140°C,恒温回流2.5h。
步骤4.将反应液冷却到120°C,直到反应完成
步骤5.将反应液倒入烧杯,并用热水洗涤三口烧瓶,洗液并入烧杯中。
步骤6.冷却结晶,抽滤,回收滤液中的二甲苯和磷酸
步骤7.用二甲苯重结晶、脱色、冷水洗涤、干燥
(1)磷酸在实验中的作用是_____。
(2)本实验中二甲苯的作用是_____。
(3)步骤4中反应完成的标志是_____。
(4)步骤7脱色时,可用的脱色剂是_____。
(5)对合成得到的产品表征,还需要的主要现代分析仪器是_____、_____。
制备水杨酸对正辛基苯基酯(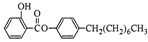 )如下:
)如下:
步骤一:将水杨酸晶体投入三颈烧瓶中,再加入氯苯,搅拌溶解后,加入无水三氯化铝。
步骤二:按图所示装置装配好仪器,水浴加热控制温度在20~40℃之间,在搅拌下滴加SOCl2,反应制得
水杨酰氯。该反应为: (水杨酸)+SOCl2→
(水杨酸)+SOCl2→ (水杨酰氯)+HCl↑+SO2↑
(水杨酰氯)+HCl↑+SO2↑
步骤三:将三颈烧瓶中的混合液升温至80℃,再加入对正辛苯酚[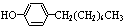 ],温度控制在100℃左右,不断搅拌。
],温度控制在100℃左右,不断搅拌。
步骤四:过滤、蒸馏、减压过滤;酒精洗涤、干燥。
(1)步骤一中加入三氯化铝的作用是。
(2)实验时,冷凝管中的水应从进出(选填“a”或“b”);装置c的作用是。
(3)步骤三中发生反应的化学方程式为 。
(4)步骤四减压过滤操作中,除烧杯、玻璃棒外,还必须使用的硅酸盐材料的仪器有 。
(5)步骤四减压过滤时,有时滤纸会穿孔,避免滤纸穿孔的措施是。
K2SO4是无氯优质钾肥,Mn3O4是生产软磁铁氧体材料的主要原料。以硫酸工业的尾气联合制备K2SO4和Mn3O4的工艺流程如下:
(1)几种盐的溶解度见图。反应III中,向(NH4)2SO4溶液中加入KCl溶液充分反应后,进行蒸发浓缩、、洗涤、干燥等操作即得K2SO4产品。
(2)检验K2SO4样品是否含有氯化物杂质的实验操作是:。
(3)反应IV的化学方程式为。
(4)Mn3O4与浓盐酸加热时发生反应的离子方程式为。
(5)下图是煅烧MnSO4•H2O时温度与剩余固体质量变化曲线。
①该曲线中B段所表示物质的化学式为。
②煅烧过程中固体锰含量随温度的升高而增大,但当温度超过1000℃时,再冷却后,测得产物的总锰含量反而减小。试分析产物总锰含量减小的原因:。