(1)乙醇是重要的有机化工原料,可由乙烯直接水合法生产。
已知:甲醇脱水反应①2CH3OH(g) = CH3OCH3(g)+H2O(g)△H1=-23.9KJ·mol-1
甲醇制烯烃反应②2CH3OH(g) = C2H4 (g)+2H2O(g)△H2=-29.1KJ·mol-1
乙醇异构化反应③CH3CH2OH(g) = CH3OCH3(g)) △H3=+50.7KJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g) C2H5OH(g) △H= ;
C2H5OH(g) △H= ;
(2)乙烯气相直接水合反应,在其他条件相同时,分别测得C2H4的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如下图。结合曲线归纳平衡转化率-T曲线变化规律:

(a) ;
(b) ;
(3)若要进一步提高乙烯的转化率,可以采取的措施有 。
A.增大乙烯的浓度
B.分离出乙醇
C.加催化剂
(4)已知t℃时,反应FeO(s)+CO(g) Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)= 。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入x mol CO,t℃时反应达到平衡。此时FeO(s)转化率为50%,求x的值。(写出计算步骤)
(8分)将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:
3A(g)+B(g) xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L。min),且此时A、B的物质的量浓度之比为3∶5。求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L。min),且此时A、B的物质的量浓度之比为3∶5。求:
(1)此时A的浓度为 .反应开始前放入容器中A、B的物质的量
(2)B的平均反应速率 .
(3)x的值是多少 .
(4)下列叙述能证明该反应已达到化学平衡状态的是。
A.溶器内压强不再发生变化
B.A的体积分数不再发生变化
C.容器内气体分子总数不再发生变化
D.相同时间内消耗3nmolA的同时消耗nmolB
E. 混合气体的平均相对分子质量不再变化
(8分)有A、B、C、D四种短周期元素,其原子序数依次增大。A、B可形成A2B和A2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物。回答下列问题。
(1)A2B2的电子式为____________。
(2)CB2通入A2B2溶液中可被氧化为W,用W的溶液(体积为1 L,假设变化前后溶液体积变化忽略不计)组装成原电池(如图所示)。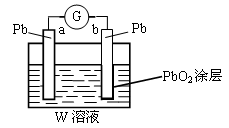
在b电极上发生的反应可表示为:PbO2+4H++SO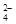 +2e-=PbSO4+2H2O,则在a电极上发生的反应可表示为_________________。若电池工作一段时间后,a极消耗0.05 mol Pb,则W的浓度由质量分数39 % (密度1.3 g / cm3)变为______mol /L。
+2e-=PbSO4+2H2O,则在a电极上发生的反应可表示为_________________。若电池工作一段时间后,a极消耗0.05 mol Pb,则W的浓度由质量分数39 % (密度1.3 g / cm3)变为______mol /L。
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期。该元素可与D形成ED2和ED3两种化合物。将E的单质浸入ED3溶液中(如下图甲所示),溶液由黄色逐渐变为浅绿色,该反应的离子方程式为____________________________________。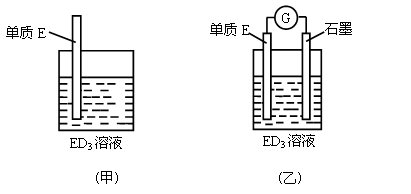
(4)依据(3)中的反应,可用单质E和石墨为电极设计一个原电池(图乙),则在该原电池工作时,石墨一极发生的反应可以表示为______________________________。
下列变化①碘的升华②烧碱熔化③氯化钠溶于水④氯化氢溶于水⑤氧气溶于水⑥氯化铵受热分解。其中(1)未发生化学键破坏的是;(2)仅发生离子键破坏的是_____;(3)仅发生共价键破坏的是(不包括范德华力);(4)既发生离子键又发生共价键破坏的是_____。
下面列出了几组物质,请将物质的合适组号填写在空格上(1)互为同位素的是。(2)互为同分异构体的是。(3)互为同素异形体的是。(4)互为同系物的是。
①金刚石与“足球烯”C60;②D2O与T2O;③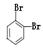 和
和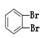
④CH4和CH3CH2CH3;⑤葡萄糖与果糖;⑥16O和18O
某同学在用托盘天平称量氯化钠时,物质和砝码放颠倒了,他要称量10.3克氯化钠,实际称量的氯化钠的质量为g