【改编】(12分)聚合硫酸铁铝(PFAS)是一种新型高效水处理剂。利用硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)为铁源、粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为铝源,制备PFAS的工艺流程如下:
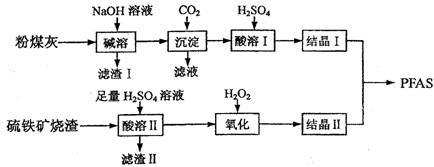
(1)滤渣Ⅰ的主要成分为 (填化学式);若通入足量的二氧化碳,滤液的主要溶质为
(填化学式)。
(2)“酸溶Ⅰ”时发生反应的离子方程式为 。
(3)“氧化”时,发生反应的离子方程式是 。“氧化”时应控制温度不超过57℃,其原因是 。
(4)酸度对絮凝效果和水质有显著影响。若产品中残留过多,使用时产生的不良后果是 。
某研究性学习小组用不纯的氧化铝(杂质为Fe2O3)为原料,设计了冶炼铝的以下工艺流程(部分反应产物没有标出):
(1)试剂X的化学式为,反应Ⅰ的离子方程式是。实验室配制480mL 1 mol·L-1 X的溶液必须用到玻璃仪器除烧杯、玻璃棒、试剂瓶、胶头滴管外,还有。常用来可以标定所配X的溶液浓度是否准确的实验名称是。
(2)按照方案设计,试剂Z的作用是调节溶液的pH,以生成沉淀b[Fe(OH)3]。从试剂工业的角度,你认为方案更合理,理由是。
(3)已知N为氨气,实验室中还可以用下图装置制取氨气并进行氨气喷泉实验。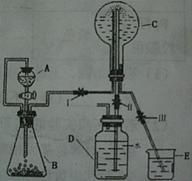
①仪器A的名称是,装置中A口部和B口部之间联通导气管的作用是。
②若用此装置制备N气,若A中盛有浓氨水,则B装置中的固体试剂不可以选用下列的(填字母序号)。
a.生石灰 b.烧碱 c.胆矾 d.碱石灰
(4)室温下,在a mol·L-1的(NH4)2SO4水溶液中pH=5,存在着平衡NH4++H2O  NH3·H2O+H+,则该平衡常数的表达式为(用含代数a的较为精确地数字表达式表示,不必化简,不做近似运算)。
NH3·H2O+H+,则该平衡常数的表达式为(用含代数a的较为精确地数字表达式表示,不必化简,不做近似运算)。
铁黄是一种重要的颜料,化学式为Fe2O3·xH2O,广泛用于涂料、橡胶、塑料、文教用品等工业。实验室模拟工业利用硫酸渣(含Fe2O3及少量的CaO、MgO等)和黄铁矿粉(主要成分为FeS2)制备铁黄的流程如下:
(1)操作Ⅰ与操作Ⅱ中都用到玻璃棒,玻璃棒在两种操作中的作用分别是、 。
(2)试剂a最好选用(供选择使用的有:铝粉、空气、浓HNO3);其作用是。
(3)上述步骤中需用到氨气。下列装置可用于实验室制氨气的是(填序号)。
(4)检验溶液Z中含有 的方法是。
的方法是。
(5)查阅资料知,在不同温度下Fe2O3被CO还原,产物可能为Fe3O4、FeO或Fe,固体质量与反应温度的关系如下图所示。
根据图象推断670℃时Fe2O3还原产物的化学式为,并设计一个简单的实验,证明该还原产物的成分(简述实验操作、现象和结论)。。仪器自选。可供选择的试剂:稀H2SO4、稀盐酸、H2O2溶液、NaOH溶液、KSCN溶液。
某氯化铁样品含有少FeC12杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
请根据上图流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有、(填仪器名称),操作Ⅱ必须用到的仪器是(填编号)。
| A.50mL烧杯 | B.50mL量筒 | C.100mL量筒 | D.25mL酸式滴定管 |
(2)①的X可选用(填化学式),其目的是。加入氨水要过量的原因是。
(3)检验沉淀是否已经洗涤干净的操作是。
(4)若蒸发皿质量是W1g,蒸发皿与加热后固体总质量W2g,则样品中铁元素的质量分数是(列出计算式,不需化简):若固体加热时未充分反应,则最终测量的结果(“偏大”、“偏小”、“不变”)。
(5)已知在常温下Cu2+和Fe3+在溶液中随pH变化时水解的曲线如图所示 。
。
对图中a点的说法正确的是(填序号)。
①加适量NH4C1固体可使溶液由a点沿水平方向变到Cu2+曲线上。
②溶液中a点和水平线在Fe3+和Cu2+曲线上任意截点的C(H+)与c(OH-)乘积相等
③Fe(OH)3、Cu(OH)2在a点代表的溶液中均达到饱和
重铬酸钾又名红矾钾,是化学实验室中的一种重要分析试剂。工业上以铬酸钾(K2CrO4)为原料,采用电化学法制备重铬酸钾(K2Cr2O7)。制备装置如下图所示(阳离子交换膜只允许阳离子透过):
制备原理:2CrO42-(黄色)+2H+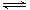 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)通电后阳极室产生的现象为,其电极反应式是。
(2)该制备过程总反应的离子方程式可表示为4CrO42-+4H2O="2" Cr2O72- + 4OH- +2H2↑+O2↑,若实验开始时在右室中加入38.8g K2CrO4,t分钟后测得右室中K与Cr的物质的量之比为3:2,则溶液中K2CrO4和K2Cr2O7的物质的量之比为;此时电路中转移电子的物质的量为。
无水AlCl3是一种重要的有机合成催化剂,该物质在183℃时升华,遇潮湿空气即产生大量白雾。某中学化学兴趣小组拟利用中学常见仪器设计实验制备无水AlCl3,实验装置如下图所示。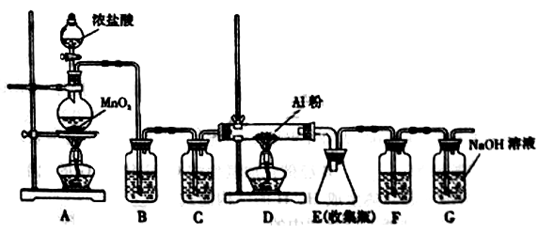
请回答下列问题:
(1)制备实验开始时,先检查装置的气密性,接下来的操作依次是。
a.加入MnO2粉末 b.点燃A中酒精灯 c.加入浓盐酸 d.点燃D处酒精灯
(2)写出A装置中发生反应的化学方程式:。
(3)装置B和C中的试剂分别是。
(4)甲同学认为F和G可以用一种仪器替代,且加入一种药品即可达到相同效果。这种药品可以是。
(5)E中得到少量白色粉末,打开软木塞后可明显观察到锥形瓶中有白雾生成,用化学方程式表示其原因。
(6)制备过程中随着盐酸的浓度下降,氯气的制取反应会停止。为测定残余液中盐酸的浓度,某同学量取残余液10.00mL,加水稀释到250.00mL。然后从中取出20.00mL,用0.1000mol·L-1的NaOH标准溶液进行滴定,终点时消耗NaOH溶液24.00mL。则该残余液体中盐酸的浓度为。