已知热化学方程式:
(1)2H2O(l)===2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
(2)2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1
当1 g液态水变为气态水时,对其热量变化有下列描述:①放出;②吸收;③2.44 kJ;④4.88 kJ;⑤88 kJ。其中正确的是
| A.②和⑤ | B.①和③ | C.②和③ | D.②和④ |
下列叙述正确的是
A.浓硝酸、浓硫酸均能将木炭氧化成二氧化碳
B.Na2O2与水反应,红热的Fe与水蒸气反应 均能生成碱
均能生成碱
C. Li、C、S分别在足量氧气中燃烧均生成一种相应氧化物
D.NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体
下列离子方程式正确的是
A.少量SO2通入 溶液中: 溶液中: |
| B.足量氯气通入溴化亚铁溶液中:3Cl2 + 2Fe2+ + 4Br-="==" 6Cl-+ 2Fe3+ + 2 Br2 |
C.在稀氨水中通入过量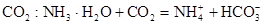 |
| D.澄清石灰水与盐酸反应:Ca(OH)2 + 2 H+ ="==" Ca2+ + 2 H2O |
在分析某些溶液中的离子成分时,为了排除其他
离子可能的干扰,通常先在溶液中加入一些试剂对干扰离子进行掩蔽以得到准确的结果。下列 掩蔽方法和分析结果正确的是
掩蔽方法和分析结果正确的是
| A.某溶液中滴加KSCN溶液呈无色,再滴加氯水后出现血红色,该溶液中含有Fe2+ |
B.某溶 液中滴加NaOH溶液后再滴加CaCl2溶液出现白色沉淀,该溶液中含有CO32- 液中滴加NaOH溶液后再滴加CaCl2溶液出现白色沉淀,该溶液中含有CO32- |
C.某溶液中滴加氨水后再滴加NaOH 溶液出现白色沉淀,该溶液中含有Al3+ 溶液出现白色沉淀,该溶液中含有Al3+ |
| D.某溶液中滴加足量稀盐酸后,再滴加BaCl2溶液才出现白色沉淀,该溶液中含有SO42- |
设NA 代表阿伏加德罗常数的数值,下列说法正确的是
| A.1 mol磷酸钾中阴离子所带电荷数为NA |
B.在18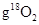 中含有 中含有 个18O原子 个18O原子 |
| C.0.10mol Fe粉与足量水蒸气反应转移的电子数为0.30 NA |
| D.将0.1mol硅酸钠溶于1L水中,所得溶液中含有0.2NA个Na+ |
若试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,原来试管中盛装的可能是什么气体
| A.可能是N2与NO2的混和气体 | B.可能是O2与NO2的混和气体 |
| C.可能是NO与NO2的混和气体 | D.只可能是NO2一种气体 |