【原创】原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。另有元素R是用途最广泛的金属。
(1)W元素在周期表中的位置为 ;写出Y元素原子的价电子排布式: 。
(2)由X、Z两元素可以组成A、B两种化合物,A在一定条件下可以分解成B,A的电子式 。
(3)X、Y两元素按原子数目比3∶l和4∶2构成分子C和D,C的空间构型为 ,D—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液,则D—空气燃料电池放电时,负极的电极反应式是: 。
(4)一定条件下,Y的单质气体与X的单质气体充分反应生成6.8g YX3气体,可放出18.44 kJ热量,则该反应的热化学方程式为 。
(5)科学家通过X射线探明,RO的晶体结构与NaCl的晶体结构相似,若在RO晶体中阴阳离子间最近距离为a cm,晶体密度为dg/cm3。则阿伏伽德罗常数NA表达式为 mol-1。
在下列几种有机物中(用编号填写)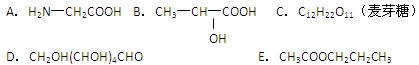
⑴既能发生银镜反应,又能发生水解反应的是。
⑵既能与酸反应,又能与碱反应的是。
⑶既能发生酯化反应,又能发生消去反应的是。
⑷酸性条件下水解产物是两种相对分子质量相等的有机物是。
(12)某元素R原子的核外电子数等于核内中子数,该元素的单质2.8g与氧气充分反应,生成6.0g的化合物RO2。请回答:
(1)元素R的原子序数是。
(2)元素R的原子共有个电子层,能量最低的电子层中共有个电子。
(3)写出元素R的最高价氧化物对应水化物的化学式,它的酸性比碳酸的酸性。
已知X、Y、Z、W四种元素是元素周期表中连续三个不同短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
(1)X、Y、Z、W四种元素的符号:
X、Y 、Z、W
(2)由以上元素中的两种元素组成的能溶于水且水溶液显碱性的化合物的电子式分别为,。
(3)由X、Y、Z所形成的离子化合物是,它与W的最高氧化物的水化物的浓溶液加热时反应的离子方程式是。
(1)写出电子式:
KCl;CO2
(2)用电子式表示下列化合物的形成过程:
CaF2:
NH3:
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:丙G
(2)写出下列反应的离子方程式:
反应①
反应⑤
(3)写出乙 + D的化学方程式。