固体A可用于工业上生产硫酸,各物质间转化如下图。其中C为红棕色粉末,D为能使品红溶液褪色的无色气体。
请回答:
(1)F的电子式为_________。
(2)若测得生成C和D的质量比为5:8,则A的化学式为______________。
(3)将D通入H溶液中发生反应的离子方程式为_____________。
(4)物质的量浓度均为0.lmol/L的G和H的混合溶液中,离子浓度由大到小的顺序为____________。
(5)有人用电解某饱和溶液的方法同时制备G的浓溶液和浓氢氧化钠溶液,如图所示。则:
①a端为电源的_________(填“正极”或“负极”)。
②N口收集的物质为__________(填化学式,下同。);Q口收集的为_________浓溶液。
③某物质的饱和溶液最好选用___________(填试剂名称)。
④阳极的电极反应式为____________。
(6)检验H中金属阳离子的方法___________。
煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为和。
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理如下图所示:
这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为,第二步反应的离子方程式为。
(3)工业煤干馏得到的产品有焦炭、。
(4)工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨—空气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到100%,理论上γ{n(O2)/n(NH3)}=,实际生产要将γ值维护在1.7—2.2之间, 原因是。
(Ⅰ)铜铁及其化合物在日常生活中应用广泛,某研究性学习小组用粗铜(含杂质Fe)与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
(1)固体A用稀盐酸溶解的原因是;
(2)检验溶液B中是否存在Fe3+的方法是;
(3)已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是;
(Ⅱ)(1) 常温下,某同学将稀盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
氨水物质的量浓度 (mol·L-1) |
盐酸物质的量浓度 (mol·L-1) |
混合溶液 pH |
| ① |
0.1 |
0.1 |
pH=5 |
| ② |
C |
0.2 |
pH=7 |
| ③ |
0.2 |
0.1 |
pH>7 |
请回答:从第①组情况分析,该组所得混合溶液中由水电离出的c(H+)=mol·L-1;从第②组情况表明,C 0.2 mol·L-1(选填“>”、“<”或“=”);从第③组情况分析可知,混合溶液中c(NH4+)
c(NH3·H2O)(选填“>”、“<”或“=”)。
(2)写出以下四组溶液NH4+离子浓度由大到小的顺序> > >(填选项编号)。
A.0.1mol·L-1NH4Cl
B.0.1mol·L-1NH4Cl和0.1mol·L-1NH3·H2O
C.0.1mol·L-1NH3·H2O
D.0.1mol·L-1NH4Cl和0.1mol·L-1HCl
对物质净化对生产生活很重要的意义。
(1)除去水中的 Ca2+,Mg2+等阳离子,完成此目标可使用________(填材料名称)。
(2)催化还原法可以净化硝酸工业尾气,下列物质中不能用于除去尾气中氮氧化物的是________(填字母序号)。
| A.NH3 | B.CH4 | C.CO2 | D.H2 |
(3)接触法制硫酸的工艺中,沸腾炉产生的炉气必须经过净化,除去其中的粉尘和______,净化后的炉气进入_____(填设备名称)。
(4)煤的气化技术的主要产物是______,将煤加’f以得到焦炉气、煤焦油及焦炭等产品的技术称为___________ 。
金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)写出Ti基态原子的电子排布。
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。则电负性CB(选填“>”“<”),第一电离能N>O,原因是。
(3)月球岩石·玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。SO2—4的空间构型为,其中硫原子采用杂化,氧原子的价电子排布图为,任意写出一种SO2—4的等电子体。
(4)将TiOSO4的稀溶液加热水解后,经进一步反应,可得到钛的某种氧化物。该氧化物的晶胞结构图如图所示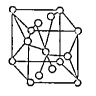 。则该氧化物的化学式(图中钛原子用“O”表示。氧原子用“O”表示)
。则该氧化物的化学式(图中钛原子用“O”表示。氧原子用“O”表示)
2012年冬天,我国城市空气污染状况受到人们的强烈关注。在空气质量报告中,SO2的指数是衡量空气质量好坏的重要指标。为了测定空气中的SO2含量,有三位同学分别采用了以下测定方法。
I.氧化还原法:甲同学拟采用下图所示的装置进行实验: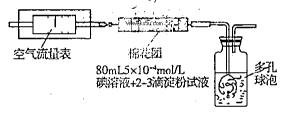
(1)该实验需要80mL5×10-4mol/L的碘溶液,甲同学应称量I2g(精确到0.001),选择_______mL的容量瓶进行配制。该实验所涉及的氧化还原反应原理为(用化学方程式表示),该实验原理是利用了SO2的性。
(2)在甲同学所配碘溶液浓度准确,并且量取药品及实验过程中各种读数均无错误的情况下,利用上述装置所测定的SO2含量仍然比实际含量低,请分析其中可能的原因.
Ⅱ.重量法:乙同学拟用右图 所示简易装置进行实验。实验操作如下:按图安装好仪器,在广口瓶中盛放足量的H2O2水溶液,用规格为20mL的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2=H2SO4)。在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.182mg。
所示简易装置进行实验。实验操作如下:按图安装好仪器,在广口瓶中盛放足量的H2O2水溶液,用规格为20mL的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2=H2SO4)。在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.182mg。
(3)取样处空气中SO2含量为mg/L(精确到0.001)。
(4)已知,常温下BaSO3的KSP为5.48×10-7饱和亚硫酸溶液中c(SO2-3)=6.3×10-8mol/L。有同学认为以上实验不必用H2O2吸收SO2,直接用0.1mol/L BaCl2溶液来吸收SO2即可产生沉淀,请用以上数据分析这样做是否可行.
III.仪器法:丙同学直接使用一种SO2浓度智能监测仪测定空气中的SO2含量,这种监测仪是利用电化学原理,根据电池产生电流的强度来准确测量SO2浓度的。该电池总的化学反应原理为:2SO2+O2+2H2O=2H2SO4
(5)请写出该电池负极的电极反应式。