将反应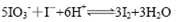 设计成如下图所示的原电池。开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流计指针再次发生偏转。下列判断不正确的是
设计成如下图所示的原电池。开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流计指针再次发生偏转。下列判断不正确的是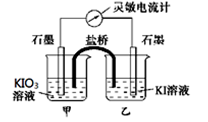
| A.开始加入少量浓硫酸时,乙中石墨电极上发生氧化反应 |
| B.开始加入少量浓硫酸时,同时在甲、乙烧杯中都加入淀粉溶液,只有乙烧杯中溶液变蓝 |
| C.电流计读数为零时,反应达到化学平衡状态 |
| D.两次电流计指针偏转方向相反 |
已知A、B、C、D、E是核电荷数依次增大的五种短周期元素,原子半径按D、E、B、C、A的顺序依次减小,B和E同主族,下列推断不正确的是()
A.A、B、E一定在不同周期 B.D为第二周期
C.A、D可能在同一主族 D.C、D的单质可能化合为离子化合物
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德。某种兴奋剂的结构简式如图所示。有关该物质的说法中,正确的是()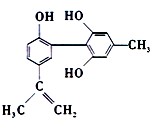
A.1mol该物质分别与浓溴水和 反应时最多消耗 反应时最多消耗 和 和 分别为4mol和7mol 分别为4mol和7mol |
B.滴入酸性 溶液振荡,紫色褪去,能证明其结构中存在碳碳双键 溶液振荡,紫色褪去,能证明其结构中存在碳碳双键 |
C.该物质与苯酚属于同系物,遇 溶液呈紫色 溶液呈紫色 |
| D.该分子中的所有碳原子不可能共平面 |
室温下,在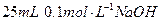 溶液中逐滴加入
溶液中逐滴加入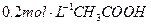 溶液,曲线如图所示,若忽略两溶液混合时的体积变化,有关粒子浓度关系的比较,错误的是()
溶液,曲线如图所示,若忽略两溶液混合时的体积变化,有关粒子浓度关系的比较,错误的是()
A.在A、B间任一点,溶液中一定都有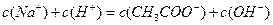
B.在B点: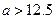 ,且有
,且有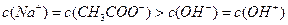
C.在C点: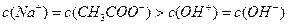
D.在D点:
下列热化学方程式中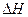 的数值能表示可燃物燃烧热的是()
的数值能表示可燃物燃烧热的是()
A.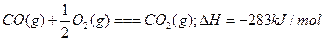 |
B.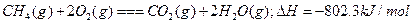 |
C.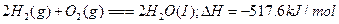 |
D.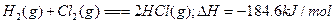 |
下列四组溶液,不用其他试剂也能鉴别开来的是()
①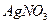 溶液、稀氨水 ②
溶液、稀氨水 ②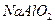 溶液和盐酸
溶液和盐酸
③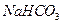 、
、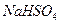 、
、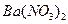 ④
④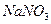 、
、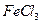 、
、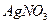
| A.只有① | B.只有①② | C.只有①②③ | D.全部 |