铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O===Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是
| A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B.电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 |
| C.电池充电过程中,阴极附近溶液的pH降低 |
| D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O |
下列所得溶液的物质的量浓度等于0.1 mol·L-1的是( )
| A.将0.1 mol氨充分溶解在1 L水中 |
| B.将10 g质量分数为98%的硫酸与990 g水混合 |
| C.将8 g三氧化硫溶于水并配成1 L溶液 |
| D.将0.1 mol氧化钠溶于水并配成1 L溶液 |
将下列溶液与1 L 0.1 mol·L-1NaCl溶液混合,所得溶液中c(Cl-)最大的是( )
| A.50 mL 1 mol·L-1NaCl溶液 |
| B.20 mL 2 mol·L-1AlCl3溶液 |
| C.30 mL 1 mol·L-1MgCl2溶液 |
| D.100 mL 3 mol·L-1NaClO3溶液 |
对1 mol·L-1的BaCl2溶液的有关叙述中,正确的是( )
| A.该溶液中Cl-浓度为2 mol·L-1 |
| B.该溶液中Ba2+的物质的量是1 mol |
| C.可使用250 mL容量瓶分两次完成490 mL该浓度的BaCl2溶液的配制 |
| D.将208 g BaCl2固体溶解在1 L水中,形成的溶液的浓度为1 mol·L-1 |
用酸性氢氧燃料电池电解饱和食盐水的装置如图所示(a、b为石墨电极,不考虑U形管
中气体的溶解且a上产生的气体全部进入小试管中)。下列说法中错误的是( )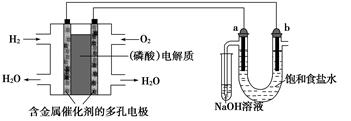
| A.同温同压下,燃料电池中参与反应的H2和O2的体积之比为2∶1 |
| B.同等条件下,U形管a、b两端产生的气体的密度之比为35.5∶1 |
| C.燃料电池中消耗0.2 g H2时,U形管中阴极产生的气体为2.24 L(标准状况下) |
| D.燃料电池中消耗1 mol O2时,小试管中反应转移的电子数约为4×6.02×1023 |
设NA表示阿伏加德罗常数,下列说法错误的是( )
| A.一定量的Fe与含1 mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA |
| B.1 mol Na2O2固体中含离子总数为4NA |
| C.常温常压下,等质量的SO2、S2含有相同的分子数 |
| D.125 g CuSO4·5H2O晶体中含有0.5NA个Cu2+ |