SiCl4在室温下为无色液体,易挥发,有强烈的刺激性.把SiCl4先转化为SiHCl3,再经氢气还原生成高纯硅.
(1)高温条件下,SiHCl3与氢气反应的方程式为: 。
(2)已知:
(ⅰ)Si(S)+4HCl(g)=SiCl4(g)+2H2(g) △H=-241KJ.mol-1
(ⅱ)Si(S)+3HCl(g)=SiHCl3(g)+H2(g) △H=-210KJ.mol-1
则SiCl4转化为SiHCl3的反应(ⅲ):3SiCl4(g)+2H2(g)+Si(S)==4SiHCl3(g) △H=______。
(3)力研究反应(iii)的最适宜反应温度,下图为四氯化碳的转化率随温度的变化曲线:由图可知该反应最适宜的温度为 ,四氯化碳的转化率随温度升高而增大的原因为____。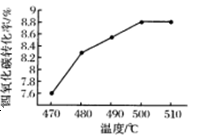
(4)一定条件下,在2L恒容密闭容器中发生反应(ⅲ),6h后达到平衡,H2与SiHCl3的物质的量浓度分别为1mol.L-1和0.2 mol.L-1
①从反应开始到平衡,v(SiCl4)=___________。
②该反应的平衡常数表达式为K= ,温度升高,K值 (填“”增大”、“减小”或“不变”)。
③原容器中,通入H2的体积(标准状况下)为 。
④若平衡后再向容器中充人与起始时等量的SiCl4和H2(假设Si足量),当反应再次达到平衡时,与原平衡相比较,H2的体积分数将 (填“增大”、“减小”或“不变”).
⑤平衡后,将容器的体积压缩为1L,再次达到平衡时,H2的物质的量浓度范围为 。
下图表示一个电解 池,电解液ɑ是足量的饱和NaCl溶液,X、Y都是石墨电极,实验开始前,在两边各滴入几滴酚酞试液,则:
池,电解液ɑ是足量的饱和NaCl溶液,X、Y都是石墨电极,实验开始前,在两边各滴入几滴酚酞试液,则:
(1)X电极上的电极反应式为,
在X极附近观察到的现象是。
(2)Y电极上的电极反应式为,
若在X电极处收集到标准状况下的气体224mL,则Y电极处生成物的质量为g 。
(1)已知天然气和水蒸气反应的热化学方程式为:CH4(g) + H2O(g)  CO(g)+ 3H2(g) ΔH =+206.4kJ·mol-1,则制得56g CO需要吸收的热量为kJ;
CO(g)+ 3H2(g) ΔH =+206.4kJ·mol-1,则制得56g CO需要吸收的热量为kJ;
(2)CO可继续与水蒸气反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH =-41.0kJ·mol-1 ,若将1mol CH4与足量水蒸气充分反应得到1molCO2,该反应的焓变ΔH =kJ·mol-1。
CO2(g)+H2(g) ΔH =-41.0kJ·mol-1 ,若将1mol CH4与足量水蒸气充分反应得到1molCO2,该反应的焓变ΔH =kJ·mol-1。
写出下列盐水解的离子方程式:
① CH3COONa
② (NH4)2SO4
③ NaHCO3
化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等都离不开化学。
⑴硅是无机非金属材料的主角。请你举出两种含硅的材料名称 ▲、 ▲。
⑵大量使用化石燃料,最直接的危害 是造成大气污染,如“温室效应”、“酸雨”等都与大量使用化石燃料有关。为了防
是造成大气污染,如“温室效应”、“酸雨”等都与大量使用化石燃料有关。为了防 治酸雨,降低煤燃烧时向大气排放的SO2,工业上将生石灰和含硫煤混合后使用。请写出燃烧时,有关“固硫”(不使硫的化合物进入大气)反应的化学方程式▲,
治酸雨,降低煤燃烧时向大气排放的SO2,工业上将生石灰和含硫煤混合后使用。请写出燃烧时,有关“固硫”(不使硫的化合物进入大气)反应的化学方程式▲,
▲;
国际上最新采用“饱和亚硫酸钠溶液吸收法”,请写出有关反应的化学方程式 ▲ 。
⑶生活中处处有化学,缺铁性贫血患者应补充Fe2+,通常以硫酸亚铁的形式,而硫酸铁则无这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是▲。如果药片已经失效,应如何检验?写出主要操作与现象 ▲。
下图表示常见物质的相互转化关系(图中反应条件及部分反应物或生成物略去)。X是黄绿色气体;M、N为金属单质,其中M是地壳中含量最多的金属元素;E为红褐色固体;反应③常用于冶炼金属。试回答下列问题: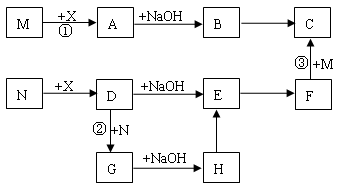
(1)物质E的化学式为 ▲。
( 2)画出X的组成元素原子结构简图 ▲。
2)画出X的组成元素原子结构简图 ▲。
(3)写出反应②的离子方程式 ▲。
(4)分别写出反应①、③的化学方程式 ▲、 ▲。