(本题共11分)氮族元素按原子序数增大,依次为:氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)。请回答:
28.常温常压下,向100mL 1.6mol/L稀氨水中逐滴滴入10mL 4.0mol/L稀硫酸,得到的溶液能使酚酞显红色。请比较所得溶液中NH4+、 NH3﹒H2O、SO42— 三种微粒的物质的量浓度大小关系: 。
29.含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢在热玻璃管中完全分解成氢气和1.50 mg单质砷。则在整个过程中,转移的电子总数为 。
30.铋酸钠(NaBiO3)溶液呈无色。向硫酸锰溶液中依次滴加下列溶液,对应的现象如表所示:
| 加入溶液 |
①适量铋酸钠溶液 |
②过量的双氧水 |
③适量KI淀粉溶液 |
| 实验现象 |
溶液呈紫红色 |
紫红色消失,产生气泡 |
溶液变成蓝色 |
请比较实验中所有的氧化剂和氧化产物的氧化性强弱关系(反应过程中的涉及的气体均不参与比较): 。
31.五氟化锑(SbF5)是无色黏稠液体,是很强的具有特殊酸性的酸,而且是超强酸氟锑酸HSbF6(目前酸性最强的酸,比纯硫酸强2×1019倍)的组分之一。SbF5可用于制备一般化学方法很难制备的氧化性极强的F2,其过程如下(均未配平):
①KMnO4 + KF + H2O2 + HF → K2MnF6 +O2 + H2O
②SbCl5 + HF → SbF5 + HCl
③K2MnF6 + SbF5 → KSbF6 + MnF3 + F2↑
反应①中氧化剂和被氧化的元素的物质的量之比为 ____;反应③中SbF5表现的性质为 ______性。
32.能在一定程度上抵消、减轻外加强酸或强碱对溶液酸度的影响,从而保持溶液的pH值相对稳定。这种溶液称为缓冲溶液。例如:人体血液中HCO3—和H2CO3等微粒形成的平衡体系,使得血液pH能稳定在7.4±0.05。某同学取19ml 0.2mol/L的NaH2PO4溶液,81ml 0.2mol/L的Na2HPO4溶液混合,配制0.2mol/L PH=7.4的磷酸缓冲溶液。已知该缓冲溶液利用的平衡体系是:H2PO4— H++HPO42—,请根据该平衡体系分析其缓冲原理: 。
H++HPO42—,请根据该平衡体系分析其缓冲原理: 。
(本题共12分)
l,6-己二酸(G)是合成尼龙(一种高分子合成纤维)的主要原料之一,可用含六个碳原子的有机化合物氧化制备。A通过氧化反应制备G的合成路线如下(可能的反应中间物质为B、C、D、E和F)。
完成下列填空:
46.化合物A中含碳87.8%,其余为氢,A的名称为___________________。
47.B到C的反应类型为______________。
48.F的结构简式为______________________________。
49.在上述中间物质中,不同环境氢原子最多的是_________,最少的是_________(填化合物代号)。
50.由G合成尼龙的化学方程式为_________________________________________________
51.写出由A通过两步反应制备1,3-环己二烯的合成路线。
(本题共10分)
化合物A有稳定性好、抗氧化能力强的特点,其结构如
分子中片段X对A的性能起了重要作用,为研究X的结构,将化合物A在一定条件下水解只得到B( )和C。经测定确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,跟NaHCO3溶液反应有CO2产生。
)和C。经测定确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,跟NaHCO3溶液反应有CO2产生。
完成下列填空:
42.化合物B能发生下列哪种类型的反应_________________
A.取代反应B.加成反应C.缩聚反应 D.氧化反应
43.化合物C能经下列反应得到G(分子式为C8H6O2,分子内含五元环)。
已知:
化合物C的结构简式为____________________________________。
44.反应F→G的化学方程式为___________________________________________________
45.化合物E有多种同分异构体,1H核磁共振谱图表明,其中某些同分异构体含有苯环,且苯环上有两种不同化学环境的氢,写出这些同分异构体中任意三种的结构简式是____________________
(本题14分)
合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g) 2NH3(g)+Q(Q>0)
2NH3(g)+Q(Q>0)
一种工业合成氨的简易流程图如下:
完成下列填空:
28.天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生。NH4HS的电子式是_______________,写出再生反应的化学方程式:_______________。NH3的沸点高于H2S,是因为NH3分子之间存在着一种比_________力更强的作用力。
29.室温下,0.1 mol/L的氯化铵溶液和0.1 mol/L的硫酸氢铵溶液,酸性更强的是_______,其原因是_______。
已知:H2SO4:Ki2=1.2×10-2 NH3·H2O:Ki=1.8×10-5
30.图甲表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:______(答案用小数表示,保留3位有效数字)。
31.依据温度对合成氨反应的影响,在图乙坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。

32.上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。
简述本流程中提高合成氨原料总转化率的方法:________________________________。
(本题10分)
元素的单质及其化合物有着广泛的用途。请根据元素周期表中第三周期元素相关知识回答下列问题。
完成下列填空:
23.按原子序数递增的顺序(稀有气体除外),以下说法正确的是。
| A.原子半径和简单离子半径均减小 |
| B.金属性减弱,非金属性增强 |
| C.氧化物对应的水化物碱性减弱,酸性增强 |
| D.单质的熔点降低 |
24.原子最外层电子数与次外层中p亚层电子数相同的元素名称是__________,磷元素原子最外层电子排布的轨道表示式是________________________________。
25.已知:
| 化合物 |
MgO |
Al2O3 |
MgCl2 |
AlCl3 |
| 类型 |
离子化合物 |
离子化合物 |
离子化合物 |
共价化合物 |
| 熔点/℃ |
2800 |
2050 |
714 |
191 |
工业制镁时,电解MgCl2而不电解MgO的原因是_______________________________;
制铝时,电解Al2O3而不电解AlCl3的原因是___________________________________。
26.晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:___________________________________。
27.KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式: _______________
下表为元素周期表的一部分,参照元素①~⑩在表中的位置,请用化学用语作答:
| 族 周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
④ |
⑤ |
||||
| 3 |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
(1)⑤、⑥、⑦的离子半径由大到小的顺序为。(填离子符号)
(2)⑧、⑨、⑩的最高价含氧酸的酸性由强到弱为。(用化学式表示)
(3)写出⑥在空气中加热生成的产物的电子式:。
(4)由表中元素形成的物质可发生下图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。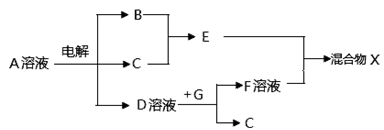
①写出D溶液与G反应的化学方程式。
②混合物X中的某物质不溶于水,但既能溶于酸又能溶于碱,请写出它在碱性溶液中的电离方程式。
(5)已知某些不同族元素的性质也有一定的相似性,如元素②与元素⑦的氢氧化物有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的离子方程式:。
(6)砷(As)的化合物可用于杀虫及医疗。
①As的原子结构示意图为。
②Y由④⑥⑩三种元素组成,是生活中常见的消毒剂。As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为。