(本题共12分)污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含少量铁,铝,铜等金属化合物)作脱硫剂,通过如下简化流程,既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。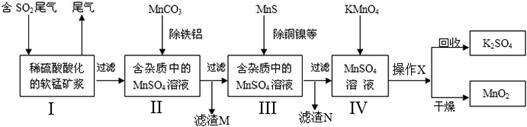
请回答下列问题:
38.上述流程脱硫实现了 (选填编号)。
a.废弃物的综合利用 b.白色污染的减少
c.酸雨的减少 d.臭氧层空洞的减少
39.步骤I生成无水MnSO4的化学方程式是 。
步骤IV生成无水MnO2的化学方程式是 。
40.步骤I中,用MnCO3能除去溶液中Al3+和Fe3+,其原因是 。滤渣M的成分是 。铜元素以 形式存在于滤渣N中。(写化学式)
41.产品MnO2可作超级电容材料。用惰性电极电解MnSO4溶液可以制得MnO2,则MnO2在 生成(填电极名称)。
42.假设脱除的SO2只与软锰矿浆中MnO2反应。按照图示流程,将2.0 m3(标准状况)含SO2的体积分数为60%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量10.44 kg。则在除去铁、铝、铜、镍等杂质的过程中,所引入的锰元素为 kg。
碳化硅(SiC) 、氧化铝(Al2O3) 和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途。
(1)Al的原子结构示意图为;Al与NaOH溶液反应的离子方程式为
。
(2)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,其反应方程式为。
(3)工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g) + 2N2(g) + 6H2(g) Si3N4(s) + 12HCl(g)△H<0
Si3N4(s) + 12HCl(g)△H<0
某温度和压强条件下,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2L密闭容器内,进行上述反应,5min达到平衡状态,所得Si3N4(s)的质量是5.60g。
①H2的平均反应速率是mol/(L·min)。
②平衡时容器内N2的浓度是mol·L-1。
③SiCl4(g)的转化率是。
④若按n(SiCl4) : n(N2) : n(H2) =" 3" : 2 : 6的投料配比,向上述容器不断扩大加料,SiCl4(g)的转化率应(填“增大”、“减”或“不变”)。
⑤工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)  Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0)
Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0)
某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应(此条件下为可逆反应),下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH恰好反应
D.反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min)
有下列几组物质:
A. H和 H和 H H |
| B.甲烷和己烷 |
| C.正丁烷和异丁烷 |
D. 和 和 |
E. 和
和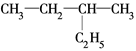
其中,①属于同分异构体的是________;②属于同位素的是________;③属于同一种物质的是________;④属于同系物的是________________。
(一)、将2 mol SO2和1 mol O2气体在1L的容器中混合,在一定条件下发生如下反应:2SO2(g)+O2 (g)  2SO3 (g)。若经过2s后测得SO3的浓度为0.6 mol/ L。试计算:(1)O2的化学反应速率V(O2)=; (2)2s时的O2浓度。
2SO3 (g)。若经过2s后测得SO3的浓度为0.6 mol/ L。试计算:(1)O2的化学反应速率V(O2)=; (2)2s时的O2浓度。
(二)、某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如下图所示。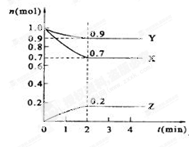
(1)X的转化率是
(2)由图中所给数据进行分析,该反应的化学方程式为;
(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=;
(4)当反应进行到第min,该反应达到平衡。
同学们已经学习了几种典型的有机化学反应类型——取代反应、加成反应,请写出下列反应的化学方程式,并判断其反应类型。
(1)由甲烷制取CH3Cl:_________________________________,属于________反应。
(2)由苯制取硝基苯:__________________________________,属于________反应。
(3)由苯制取环己烷:__________________________________,属于________反应。
电解原理在工业中有广泛应用。右图表示一个电解池,装有电解液a ;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: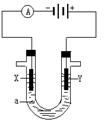
(1)若X、Y是惰性电极,a是200mLNaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,则电解池中X极上的电极反应为_____,在X极附近观察到的现象是 :_______。Y电极上的电极反应式是_________,检验该电极反应产物的方法是 :________________。当外电路通过0.02 mol电子时,充分混合电解后的溶液,忽略溶液体积变化,理论上溶液的PH值为_______。
(2)如果用电解方法精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是_________,Y电极的材料是______,Y电极反应式是_______________。