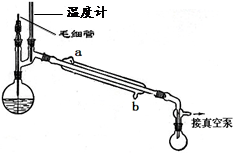
(14分)锰锌铁氧体可制备隐形飞机上吸收雷达波的涂料。以废旧锌锰电池为原料制备锰锌铁氧体(MnxZn1-xFe2O4)的主要流程如下,请回答下列问题: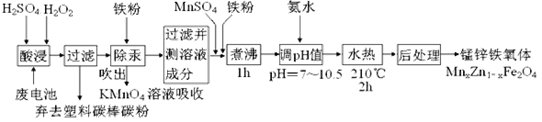
(1)酸浸时,二氧化锰被双氧水还原的化学方程式为 。
(2)活性铁粉除汞时,铁粉的作用是 (填“氧化剂”或“还原剂”或“吸附剂”)。
(3)除汞是以氮气为载气吹入滤液中,带出汞蒸汽经KMnO4溶液进行吸收而实现的。下图是KMnO4溶液处于不同pH时对应Hg的单位时间去除率变化图,图中物质为Hg与 MnO4- 在该pH范围内反应的主要产物。
①pH<6时反应的离子方程式为 。
②请根据该图给出pH对汞去除率影响的变化规律: 。
③试猜想在强酸性环境下汞的单位时间去除率高的原因: 。(不考虑KMnO4在酸性条件下氧化性增强的因素)
(4)当x=0.2时,所得到的锰锌铁氧体对雷达波的吸收能力特别强,试用氧化物的形式表示该锰锌铁氧体的组成 。
(5)经测定滤液成分后,需加入一定量的MnSO4和铁粉,其目的是 。
实验室可用如图所示的装置进行CO和CO2混合气体的分离和干燥。已知a为止水夹,b为分液漏斗丙的活塞,可供选用的试剂有NaHCO3溶液、NaOH溶液、NaHS溶液、浓硫酸、无水氯化钙、稀硫酸。试填空回答:
(1)广口瓶甲中应放的试剂为,广口瓶乙中应放的试剂为,分液漏斗丙中应放的试剂为。
(2)第一步应先分离出,分离时应先关闭。打开,发生反应的离子方程式为。
(3)第二步分离出时,先关闭,打开,发生反应的离子方程式为。
[实验化学]
图是实验室用乙醇与浓硫酸和溴化钠反应来制备溴乙烷的装置,反应需要加热,图中省去了加热装置。有关数据见表:
| 乙醇 |
溴乙烷 |
溴 |
|
| 状态 |
无色 液体 |
无色 液体 |
深红棕色 液体 |
| 密度/g·cm-3 |
0.79 |
1.44 |
3.1 |
| 沸点/℃ |
78.5 |
38.4 |
59 |
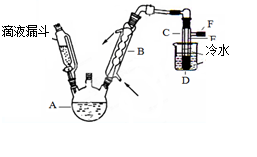
(1)制备操作中,加入的浓硫酸必需进行稀释,其目的是 (选填序号)。
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(2)写出溴化氢与浓硫酸加热时发生反应的化学方程式 。
(3)图中试管C中的导管E的末端须在水面以下,其原因是 。
(4)加热的目的是 。
(5)为除去产品中的一种主要杂质,最好选择下列 (选填序号)溶液来洗涤产品。
A.氢氧化钠 B.碘化亚铁 C.亚硫酸钠 D.碳酸氢钠
(6)第(5)步的实验所需要的玻璃仪器有 。
(15分)过二硫酸钾(K2S2O8)是一种无色结晶,易溶于水,不溶于乙醇,有强氧化性,易分解。实验室制备过二硫酸钾可通过低温电解KHSO4溶液得到。
实验步骤如下:
步骤1.称取KHSO4溶解蒸馏水,倒入大试管,试管浸在冰水浴中(装置见图9),并冷却到5℃以下。
步骤2. 电解2h,每隔约半小时补一次冰
步骤3.过滤
步骤4.
步骤5.干燥、称重
(1)电解时溶液温度控制在5℃以下的原因是 。
(2)电解时阳极反应式为 。电解过程中, 阳极产生微量且能使湿润的KI-淀粉变蓝的单质气体,该气体可能是 (填化学式)。
(3)步骤4操作是 。
(4)取得到的样品0.2500g溶于30mL水,加4gKI,塞住瓶塞,振荡,静止15min,加入1mL冰醋酸,再用cmol·L- 1Na2S2O3溶液滴定。
(S2O82- +3I- =2SO42- +I3-;I3- I2+I-;2S2O32-+I2=2I- + S4O62-)
I2+I-;2S2O32-+I2=2I- + S4O62-)
①溶解时,加入KI后需塞住瓶塞,其目的是 。
②本实验所用的指示剂为 。
③若本次滴定消耗Na2SO3溶液VmL,由本次结果计算,样品中K2S2O8的纯度为 (用含c、V的代数式表示)。
(5)分析化学上检验Mn2+在Ag+催化下K2S2O8溶液将Mn2+氧化为紫色的MnO4-,该反应的离子方程式为 。
已知某醇燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如下表所列的实验结果(假设产生的气体完全被吸收):
| 实验前 |
实验后 |
|
| (干燥剂+U形管)的质量 |
101.1 g |
102.9 g |
| (石灰水+广口瓶)的质量 |
312.0 g |
314.2 g |
根据实验数据求:
(1)实验完毕后,生成物中水的质量为________ g,
假设广口瓶里生成一种正盐,其质量为________ g;
(2)生成的水中氢元素的质量为________ g;
(3)生成的二氧化碳中碳元素的质量为________ g;
(4)该燃料中碳元素与氢元素的质量比为________;
(5)已知这种醇的每个分子中含有一个氧原子,则该醇的分子式为__________,结构简式为_______________________________。
乙酰乙酸乙酯(CH3COCH2COOC2H5)是一种不溶于水的液体,熔点:-45 °C,沸点:180.8℃,它是有机合成中常用的原料。在实验室,它可以由乙酸乙酯在乙醇钠的催化作用下缩合而制得,反应式为:2CH3COOC2H5 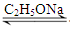 CH3COCH2COOC2H5+C2H5OH。反应中催化剂乙醇钠是由金属钠和残留在乙酸乙酯中的微量乙醇作用生成的,而一旦反应开始,生成的乙醇又会继续和钠反应生成乙醇钠。乙酰乙酸乙酯制备的流程如下:
CH3COCH2COOC2H5+C2H5OH。反应中催化剂乙醇钠是由金属钠和残留在乙酸乙酯中的微量乙醇作用生成的,而一旦反应开始,生成的乙醇又会继续和钠反应生成乙醇钠。乙酰乙酸乙酯制备的流程如下: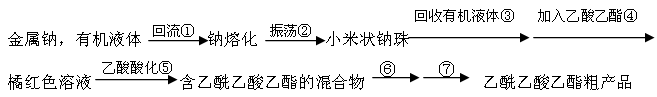
阅读下面关于乙酰乙酸乙酯制备的实验过程,并回答有关问题。
(1)将适量干净的金属钠放入烧瓶中,为了得到小米状的钠珠,需将钠熔化,为了防止钠的氧化,熔化时需在钠上覆盖一层有机液体,下表是钠和一些常用有机液体的物理性质:
| 钠 |
苯 |
甲苯 |
对二甲苯 |
四氯化碳 |
|
| 密度(g/cm3) |
0.97 |
0.88 |
0.87 |
0.86 |
1.60 |
| 熔点(℃) |
97.8 |
5.5 |
-95 |
13.3 |
-22.8 |
| 沸点(℃) |
881.4 |
80 |
111 |
138. 4 |
76.8 |
最好选用来熔化钠。是否能用四氯化碳?(填“是”或“否”)理由是。
(2)将烧瓶中的有机液体小心倾出,迅速加入适量乙酸乙酯,装上带有一根长玻璃导管的单孔胶塞,并在导管上端接一个干燥管。缓缓加热,保持瓶中混合液微沸状态。在实验中,使用烧瓶必须干燥,原料乙酸乙酯必须无水,原因是。烧瓶配上长导管的作用是,导管上端接一干燥管的目的是。
(3)步骤⑥为向混合溶液中加入饱和食盐水,其目的是,写出步骤⑦实验操作的主要仪器(填最主要一种)。
粗产品(含乙酸乙酯和少量水及乙酸等)经过几步操作,最后成为纯品。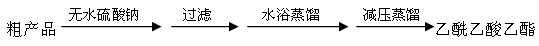
(4)向分离出的乙酰乙酸乙酯粗产品中加无水硫酸钠固体的作用是。
(5)精馏乙酰乙酸乙酯时需要减压蒸馏,装置如图所示。冷凝管的进出水方向应口进,口出。毛细管的作用是。