实验室利用冰醋酸和正丁醇制备乙酸正丁酯,实验装置如下图所示,可能用到的有关数据如下表: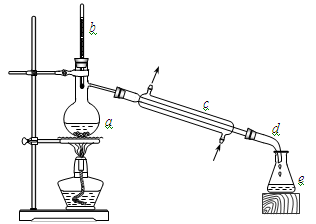
| |
正丁醇 |
冰醋酸 |
乙酸正丁酯 |
正丁醚 |
| 密度/(g/cm3) |
0.810 |
1.049 |
0.882 |
0.7689 |
| 沸点/℃ |
118.0 |
118.1 |
126.1 |
142 |
合成反应:在干燥的a中加入9.32 g正丁醇、7.2 mL 冰醋酸和3~4滴浓硫酸,摇匀后,加几粒沸石,c中通水,开始缓慢加热,控制馏出物的温度不超过130℃。
分离提纯:①将仪器a中反应后的混合液与仪器e中的馏出物合并,转入分液漏斗中;②依次用水、少量的10%碳酸钠溶液和水洗涤,分离后再加干燥剂M,静置一段时间后,弃去M;③将最终得到的反应粗产物转入洗净的仪器a中,加入几粒沸石,进行蒸馏,得到乙酸正丁酯7.31 g。
请回答下列问题:
(1)仪器a的名称是_____________。
(2)在分液时应选如图装置中的____(填序号),使用该仪器前应先___。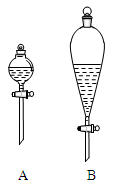
(3)写出制备乙酸正丁酯的化学方程式:_______________________。
(4)第一次水洗的目的是____________________________。
(5)干燥剂M可以是_______(填序号)
A.五氧化二磷 B.无水硫酸钠
C.碱石灰 D.氢氧化钠固体
(6)步骤③得到的粗产品蒸馏提纯时,下图所示装置中,温度计位置可能导致收集到的产品中混有高沸点杂质的装置为______(填序号)
(7)本实验所得到的乙酸正丁酯的产率是__________(填序号)
A.30% B.40% C.50% D.55%
有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、KCl等混合而成,为检验它们,做了如下实验:
①将固体混合物溶于水,搅拌后得无色透明溶液;
②往此溶液中滴加BaCl2溶液,有白色沉淀生成;
③过滤,将沉淀物置于足量稀硝酸中,发现沉淀全部溶解.
试判断:
(1)固体混合物中肯定有 ,肯定没有 ,可能有 .
(2)写出实验③中的离子方程式: .
(3)对可能有的物质进行确认,把③的滤液做进一步鉴别操作,写出你所设计的实验方案(包括具体操作步骤和实验现象) .
某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究.
(1)提出假设
①该反应的气体产物是CO2.
②该反应的气体产物是CO.
③该反应的气体产物是 .
(2)设计方案
如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比.
(3)查阅资料
氮气不与碳、氧化铁发生反应.实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气.请写出该反应的离子方程式: .
(4)实验步骤
①按图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气.冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g.
步骤②、④中都分别通入N2,其作用分别为 .
(5)数据处理
试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式: .
(6)实验优化学习小组有同学认为应对实验装置进一步完善.
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是 .
②从环境保护的角度,请你再提出一个优化方案将此实验装置进一步完善: .
某兴趣小组对铜与浓硫酸反应产生的黑色沉淀(可能含有CuO、CuS、Cu2S,其中CuS和 Cu2S不溶于稀盐酸、稀硫酸)进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插人浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为 .
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是 .
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
| 装置 |
现象 |
结论及解释 |
 |
①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 |
a.现象②说明褐色沉淀具有 性. b.试管B中产生白色沉淀的总反应的离子方程式为 |
(4)CuS固体能溶于热的浓硫酸,请用有关平衡移动原理加以解释: .
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4﹣+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4﹣+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2溶液反应完全.则混合物中Cu2S 的质量分数为 .
池州八中一化学实验小组在同样的实验条件下,用同样的实验仪器和方法进行两组中和热测定的实验,实验试剂及用量如下表所示。
反应物 |
起始温度(0C) |
终了温度 (0C) |
中和热(kJ·mol-1) |
|
| 硫酸 |
碱溶液 |
|||
| ①0.5mol/LH2SO4溶液50ml、 1.1mol/LNaOH溶液50ml |
24.8 |
24.9 |
ΔH1 |
|
| ②0.5mol/LH2SO4溶液50ml、 1.1mol/LNH3·H2O溶液50ml |
24.8 |
24.9 |
ΔH2 |
(1)该实验小组所用的主要玻璃仪器有量筒、大小烧杯和 、
(2)实验①、②中碱液过量的目的是
(3)上表中需要测定的终了温度是
(4)该实验小组中一同学预计ΔH1≠ΔH2 ,其依据是
实验小组通过测定,实验①中放出的热量约为2.84KJ,则ΔH1=
(5)若实验①中硫酸用等体积、等浓度的盐酸代替,不考虑中和反应时HCl的挥发,则测得中和反应过程中放出的热量Q (填“偏大”、“偏小”或“不变”,下同),测得的中和热ΔH 。
某学生在如下图所示装置中用苯和液溴制取溴苯,请根据下列实验步骤完成有关问题:
(1)第一步,在分液漏斗中依次加入10 mL苯和5 mL液溴,使之混合均匀,此时观察到溴溶于苯,不反应,溶液呈深棕红色。
第二步,打开分液漏斗活塞,将苯、溴混合液按一定速率逐滴加入玻璃管甲中的铁丝上,观察到的现象是剧烈反应,玻璃管甲和导管C中有橙红色蒸气。从上述两步观察到的现象差异,可得出的结论是______________________。
(2)第三步,几分钟后,打开胶皮管夹A和B,使反应混合液流入U形管中,打开管夹B的原因是______________________;然后通过分液漏斗向U形管中加入适量的NaOH溶液,目的是(用化学方程式表示)_ 。
(3)第四步,关闭胶皮管A和B,连同A和B一起取下U形管,用力振荡并静置后,观察到无色的溴苯,它在U形管中液体的_ (填“上”或“下”)层。
(4)要证明上述溴跟苯的反应是取代而不是加成反应,请根据装置乙的作用完成下列各题:
小试管内的液体是__________(填名称)。
锥形瓶内的液体是__________(填名称)。
反应后,向锥形瓶内滴加试剂__________(填名称)溶液,作用是 。
(5)写出上述苯跟溴反应的化学方程式__________________________。