氮的重要化合物如氨(NH3)、肼(N2H4)、三氟化氮(NF3)等,在生产、生活中具有重要作用。
(1)利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
①H2O(l)=H2O(g) △H1=44.0 kJ·mol-1
②N2(g)+O2(g)=2NO(g) △H2=229.3 kJ·mol-1
③4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-906.5 kJ·mol-1
④4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H4
则△H4= kJ·mol-1。
(2)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
①写出该反应的离子方程式: 。
②在纳米钴的催化作用下,肼可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图1所示,则N2H4发生分解反应的化学方程式为: ;为抑制肼的分解,可采取的合理措施有 (任写一种)。
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如上图2所示。
①氮化硅的化学式为 。
②a电极为电解池的 (填“阴”或“阳”)极,写出该电极的电极反应式: ;电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是 。
软锰矿中含MnO2约70%,SiO2约20%,Al2O3约4%,其余为水分;闪锌矿中含ZnS约80%,FeS、CuS、SiO2共约7%,其余为水分。科研人员开发了综合利用这两种资源的同槽酸浸工艺,制取Zn、MnO2和Na2SO4。其工艺流程如下: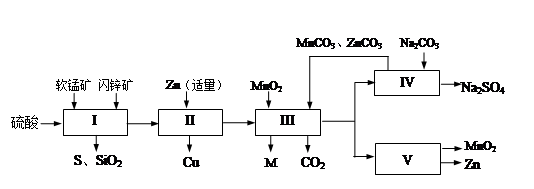
(1)I的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等。写出MnO2、CuS与硫酸反应的化学方程式:;
(2)已知Fe(OH)3、Al(OH)3、Zn(OH)2三种物质开始沉淀和完全沉淀时溶液的pH如下表:
| 沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Zn(OH)2 |
| 开始沉淀pH |
2.3 |
4.0 |
5.6 |
| 完全沉淀pH |
4.1 |
5.2 |
8.0 |
则III中调节溶液的pH至5.2~5.4,此时生成沉淀M的成分为(写化学式),III中加入MnO2的作用是;
(3)Na2SO4和Na2SO4·10H2O的溶解度曲线(g/100g水)如图,则IV中得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液升温结晶、、用乙醇洗涤后干燥。用乙醇洗涤而不用水洗的原因是;
(4)V是用惰性电极电解制得Zn和MnO2,则阳极的电极反应式为;
(5)绿色化学思想在本工艺中得到了充分体现,在本工艺流程中可循环使用的主要物质有:MnO2、ZnCO3、MnCO3、和(写化学式)。
锆产业是极有发展潜力及前景的新兴产业,锆(Zr)元素是核反应堆燃料棒的包裹材料,二氧化锆(ZrO2)可以制造耐高温纳米陶瓷。我国有丰富的锆英石(ZrSiO4),含Al2O3、SiO2、Fe2O3等杂质,生产锆流程之一如下: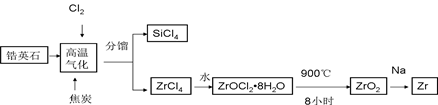
试回答下列问题:
(1)写出上述流程中高温气化的反应方程式(碳转化成CO):;
(2)写出ZrOCl2•8H2O在900℃生成ZrO2的反应方程式;
(3)关于二氧化锆纳米陶瓷和锆合金的说法不正确的是(单选);
| A.二氧化锆纳米陶瓷是新型无机非金属材料 |
| B.1纳米=10-10米 |
| C.锆合金的硬度比纯锆要高 |
| D.日本福岛核电站的爆炸可能是由锆合金在高温下与水蒸气反应产生的氢气爆炸引起 |
(4)一种新型燃料电池,一极通入空气,另一极通入丁烷;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。在熔融电解质中,O2-向(填正负)极移动。电池正极电极反应为:,负极电极反应为:。
为了提高资源利用率,减少环境污染,化工集团将钛厂、氯碱厂和甲醇厂组成产业链,如下图所示。
请填写下列空白:
(1)钛铁矿进入氯化炉前通常采取洗涤、粉碎、烘干、预热等物理方法处理,请从原理上解释粉碎的作用___________________;已知氯化炉中反应氯气和焦炭的理论用料物质的量比为7∶6,则氯化炉中的还原剂化学式是________________________;
(2)已知:①Mg(s)+Cl2(g)=MgCl2(s)△H=-641kJ•molˉ1
② 2Mg(s)+TiCl4(s)=2MgCl2(s)+Ti(s)△H=-512kJ•molˉ1
则Ti(s)+2Cl2(g)= TiCl4(s)△H=;
(3)Ar气通入还原炉中并不参与反应,通入Ar气的作用是_______________________;
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为:2CH3OH+3O2+4OHˉ=2CO32ˉ+6H2O,该电池中负极上的电极反应式是:2CH3OH-12eˉ+16OHˉ=2CO32ˉ+12H2O。则正极上发生的电极反应为:___________。工作一段时间后,测得溶液的pH是____(填“减小”、“增大”或“不变”)。
甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油。
已知:①CH4 (g) + H2O (g)= CO (g)+3H2 (g)△H1=+206.2kJ·mol-1
② CH4(g)+ O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
③CH4 (g) + 2H2O (g) =CO2 (g) +4H2 (g)△H3="+165.0" kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为。
(2)从原料选择和能源利用角度,比较方法①和②,为合成甲醇,用甲烷制合成气的适宜方法为(填序号),其原因是。
(3)合成气中的H2可用于生产NH3,在进入合成塔前常用Cu(NH3)2Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:
Cu(NH3)2Ac + CO + NH3 [Cu(NH3)3]Ac·CO△H<0
[Cu(NH3)3]Ac·CO△H<0
Cu(NH3)2Ac溶液吸收CO的适宜生产条件应是。
(4)将CH4设计成燃料电池,其利用率更高,装置示意如右图(A、B为多孔性碳棒)。持续通入甲烷,在标准状况下,消耗甲烷体积VL。
① 0<V≤44.8 L时,电池总反应方程式为;
② 44.8 L<V≤89.6 L时,负极电极反应为;
③ V="67.2" L时,溶液中离子浓度大小关系为。
工业上在催化剂作用下可利用CO合成甲醇:CO(g)+2H2(g) CH3OH(g),图1表示反应过程中能量的变化情况。
CH3OH(g),图1表示反应过程中能量的变化情况。
请回答下列问题:
(1)在图I中,曲线______(填“a”或“b”)表示使用了催化剂;该反应属于______(填“吸热”或“放热”)反应。
(2)为探究外界条件对合成甲醇化学反应速率的影响规律,某科技工作者设计了以下三组实验,部分数据已填人表中,请补充完整。
| 实验组 |
T/℃ |
起始浓度/mol•L-1 |
等质量催化剂的 比表面积/m2•g-1 |
|
| CO |
H2 |
|||
| ① |
280 |
1.20×10-3 |
5.80×10-3 |
82 |
| ② |
280 |
1.20×10-3 |
5.80×10-3 |
124 |
| ③ |
350 |
124 |
其中设计实验组①和②的目的是______。
(3)“图2”所揭示的规律是:在p1压强达平衡时______;并请画出在p2压强下(p2> p1)的曲线。
(4)在碱性条件下可将合成甲醇的反应设计成原电池,则负极的电极反应式为______。