【选做题】本题包括A、B两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分。
A.[物质结构与性质]X、Y、Z、M为前四周期中除氢以外原子序数依次增大的四种元素,X基态原子未成对电子数在所处周期中最多;Y元素原子核外共有3个能级,且最高能级电子数是前两个能级电子数之和;Z的单质常温下为淡黄色固体,ZY3分子呈平面正三角形;M原子外围电子排布式为3dn4sn。
请回答下列问题:
(1)X、Y、Z三种元素原子第一电离能由大到小的顺序是 。(用元素符号表示)
(2)某X氢化物分子结构式为:H-X=X-H,该分子中X原子的杂化方式是 ;Y元素简单氢化物的沸点高于Z的氢化物,主要原因是 。
(3)根据等电子原理,写出X2Y分子的电子式: 。
(4)M晶体的原子堆积方式为六方堆积(如图所示),则晶体中M原子配位数是 。某M配合物化学式是[M(H2O)5Cl]Cl2·H2O,1 mol该配合物中含配位键的数目是 。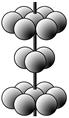
【化学选修5:有机化学基础】
PET是世界上产量最大的合成纤维,其结构简式为:
现以煤的干馏产品A与F为原料制备PET,生产流程如下图所示。其中A为烃,含碳元素的质量分数为90.6%,其蒸气的密度是空气密度的3.66倍,能使酸性高锰酸钾溶液褪色,但不能使溴水褪色。M分子里所有原子共平面。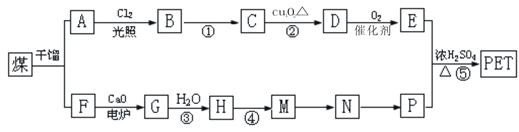
请回答下列问题:
(1)指出下列反应类型:④⑤
(2)指出反应①的反应条件:
(3)写出有机物的结构简式,A:;N:。
(4)写出下列反应的化学方程式:
反应②反应③ 反应⑤
反应⑤
(5)P的一种同系物X分子式为C3H8O2,在核磁共振氢谱图中出现三种信号峰,其峰的强度之比为2︰1︰1。则X的结构简式为。
【化学选修3:物质结构与性质】(15分)
Q、R、X、Y、Z为周期表前四周期元素,原子序数依次递增。已知:
①Q为元素周期表中原子半径最小的元素;
②R的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;
③Y的基态原子的核外成对电子数是未成对电子数的3倍;
④Q、R、Y三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,Q、R两种元素组成的原子个数比为1:1的化合物N是中学化学中常见的有机溶剂;
⑤Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同。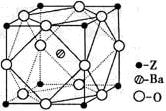
请回答下列问题(答题时,Q、R、X、Y、Z用所对应的元素符号表示)
(1)化合物M的空间构型为,其中心原子采取杂化;化合物N在固态时的晶体类型为。
(2)R、X、Y三种元素的第一电离能由小到大的顺序为;
(3)由上述一种或多种元素组成的与RY2互为等电子体的分子为(写分子式)
(4)由R、X、Y三种元素组成的RXY-离子在酸性条件下可与NaClO溶液反应,生成X2、RY2等物质。该反应的离子方程式为。
(5)Z原子基态时的外围电子排布式为;Z的一种含氧酸钡盐的晶胞结构如图所示,晶体内与每个Z原子等距离且最近的氧原子数为
【化学选修2:化学与技术】(15分)
工业上为了使原料和能量得到充分的利用,常常采用循环操作。
I、利用热化学循环制氢能缓解能源矛盾。最近研究发现,复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解水制氢。MnFe2O4的制备: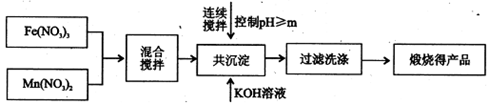
已知Fe3+、Mn2+沉淀的pH如右表所示。
| 开始沉淀 |
完全沉淀 |
|
| Fe3+ |
2.7 |
4.2 |
| Mn2+ |
8.3 |
10.4 |
(1)此工艺中理论上投入原料Fe(NO3)3和Mn(NO3)2的物质的量之比应为。
(2)控制pH的操作中m的值为。
II、用MnFe2O4热化学循环制取氢气: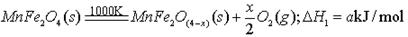
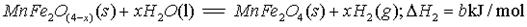
(3)由上可知,H2燃烧的热化学方程式是。
(4)该热化学循环制取氢气的优点是 (填字母编号)。
(填字母编号)。
A.过程简单、无污染 B.物料可循环使用
B.物料可循环使用
C.氧气和氢气在不同步骤生成,安全且易分离
III、工业上可用H2、HCl通过下图的循环流程制取太阳能材料高纯硅。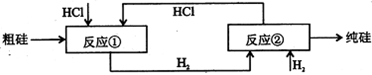
反应①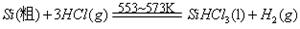
反应②: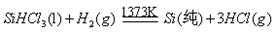
(5)上图中,假设在每一轮次的投料生产中,硅元素没有损失,反应①中HCl的利用率和反应②中H2的利用率均为75%。则在下一轮次的生产中,需补充投入HCl和H2的体积比是。
近期因“召回门”而闹的沸沸扬扬的丰田Prius属第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态。
(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,每生成1 mol水蒸气放热569.1 kJ。则该反应的热化学方程式为__________________。
(2)混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液。镍氢电池充放电原理示意如图,其总反应式是:

根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH将(填“增大”、“不变”或“减小”),该电极的电极反应式为。
(3)汽车尾气中的一氧化碳是大气污染物,可通过如下反应降低其浓度:
CO(g)+1/2O2(g) CO2(g)。
CO2(g)。
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示。请填写表中的空格。
| 容器编号 |
c(CO)/mo1·L-1 |
c (02)/mol·L-1 |
c (C02)/mol·L-1 |
v(正)和v (逆)比较 |
| I |
2.0×10-4 |
4.0 ×10-4 ×10-4 |
4.0×10-2 |
v(正)=v(逆) |
| Ⅱ |
3.0×10-4 |
4.0×10-4 |
5.0×10-2 |
②相同温度下,某汽车尾气中CO、CO2的浓度分别为1.0×10-5mol·L-1和1.0×10-4mol·L-1。若在汽车的排气管上增加一个补燃器,不断补充O2并使其浓度保持为1.0×10-4mol·L-1,则最终尾气中CO的浓度为_________mol·L-1。
如图表示由元素周期表中1~20号且不同主族元素组成的单质及化合物之间转化关系(产物中的水已略去)。其中A为单质;在实验室中,常用固体B和固体C加热制取气体F;F与G的组成元素相同,G与I分子所含电子数相同。请回答:
(1)写出B、G的化学式B、G。
(2)写出C的电子式;反应④的实验现象为;
(3)向具有漂白作用的D溶液加入I的稀溶液,写出反应的离子方程式:
(4)向D的溶液加入I的浓溶液有A生成,其反应的离子方程式为:。
(5)写出反应③的化学方程式。