【改编】甲、乙、丙、X是中学化学中常见的物质,在一定条件下,它们之间的转化关系如下图所示(部分产物已略去):

请回答下列问题:
(1)若X是 O2,则甲不可能是______(填代号)
a.Mg b.N2 c.S d.Al
(2)若甲能使湿润的红色石蕊试纸变蓝,丙为红棕色气体。写出甲转化为乙的化学方程式:________________________________________。
(3)若乙是一种常见的温室气体,则构成X的元素的电子排布式为__________。
(4)若丙为淡黄色粉末,常用作呼吸面具中的供氧剂,则丙中含有的化学键为 ;
(5)若X是一种常见的金属单质,常温下甲的浓溶液可盛放在铝制容器中,丙为浅绿色溶液。
检验乙是否完全转化为丙的试剂为____ ___(填试剂名称)。
设水的电离平衡线如图3-4所示:(1)若以A点表示20 ℃时水在电离平衡时的离子浓度,当温度上升到100 ℃时,水的电离平衡状态到B点。则此时水的离子积______从增大到______。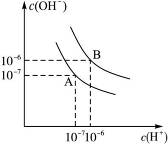
图3-4
(2)将100 ℃时pH=8的Ba(OH)2溶液与pH=5的稀H2SO4混合,并保持100 ℃的恒温。欲使混合液的pH=7,则Ba(OH)2与稀H2SO4的体积比为(二者混合后体积假设为二者体积之和)。
常温下,有pH=12的NaOH溶液100 mL,若将其pH变为11(溶液混合造成的体积变化忽略不计,计算结果保留小数点后一位)。
(1)若用pH=10的NaOH溶液,应加入 mL。
(2)若用pH=2的盐酸,应加入mL。
(3)若用0.01 mol·L-1的CH3COOH溶液V1 mL,则V1的取值范围为__________。
(4)若用pH=2的任意一元弱酸HR溶液V2 mL,则V2的取值范围为_________。
某温度下,纯水中由H2O电离出的c(H+)=2×10-7mol·L-1,则此时H2O电离出的c(OH-)=__________mol·L-1,该温度下,浓度为0.01 mol·L-1的NaOH溶液的pH=__________。
在25 ℃时,有pH=a(a≤6)的盐酸Va L和pH=b(b≥8)的NaOH溶液Vb L。二者混合恰好完全中和。问:
(1)若a+b=14时,则 =_________(填数值);
=_________(填数值);
(2)若a+b=13时,则 =_________(填数值);
=_________(填数值);
(3)若a+b>14时,则 =_________(填表达式),且VaVb(填“>”“<”或“=”)。
=_________(填表达式),且VaVb(填“>”“<”或“=”)。
有等体积、等物质的量浓度的氢硫酸和亚硫酸溶液各两份,分别通入Cl2和O2,溶液的pH变化(y)与通入气体的量x的关系如图3-6所示,则a、b、c、d分别所代表的pH变化与之对应的化学反应分别是:
图3-6
| A.在氢硫酸中通入O2_________________; |
| B.在亚硫酸中通入O2_________________; |
| C.在氢硫酸中通入Cl2_________________; |
| D.在亚硫酸中通入Cl2_________________。 |