[化学——选修2化学与技术]
(1)我国某地区已探明蕴藏有丰富的赤铁矿(主要成分为Fe2O3,还含有SiO2等杂质)、煤矿、石灰石和黏土。拟在该地区建设大型炼铁厂。
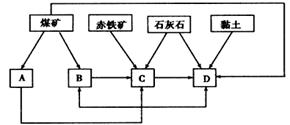
①随着铁矿的开发和炼铁厂的建立,需要在该地区相应建立焦化厂、发电厂、水泥厂等,形成规模的工业体系。据此确定图中相应工厂的名称:
| A.________, | B.________, | C.________, | D.________; |
②以赤铁矿为原料,写出高炉炼铁中得到生铁和产生炉渣的化学方程式:______________。
(2)玻璃钢可由酚醛树脂和玻璃纤维制成。
①酚醛树脂由酚醛和甲醛缩聚而成,反应有大量热放出,为防止温度过高,应向有苯酚的反应釜________地加入甲醛,且反应釜应装有________装置。
②玻璃钢中玻璃纤维的作用是______。玻璃钢具有 等优异性能(写出两点即可)。
③下列处理废旧热固性酚醛塑料的做法合理的是________。
a.深埋 b.粉碎后用作树脂填料
c.用作燃料 d.用有机溶剂将其溶解,回收树脂
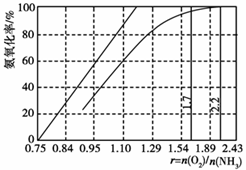
(3)工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨-空气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到100%,理论上r[n(O2)/n(NH3)]=_____,实际生产要将r值维持在1.7~2.2之间,原因是__________________________。
A、B、C、D、E、F和G都是有机化合物,它们的关系如图所示: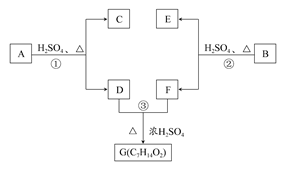
(1)化合物C的分子式是C7H8O,C遇FeCl3溶液显紫色,C的苯环上的一溴代物只有两种,则C的结构简式为;
(2)D为一直链化合物,其相对分子质量比化合物C的小20,它能跟NaHCO3反应放出CO2,则D的分子式为,D具有的官能团名称是;
(3)反应①的化学方程式是;
(4)芳香化合物B是与A具有相同官能团的A的同分异构体,通过反应②化合物B能生成E和F,F可能的结构简式是;
(5)E可能的结构简式是。
《茉莉花》是一首脍炙人口的江苏民歌。茉莉花香气的成分有多种,乙酸苯甲酯
(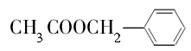 )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下: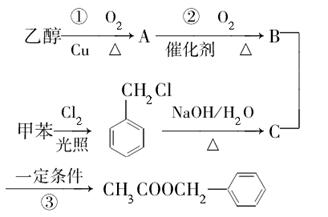
(1)C的结构简式为。
(2)写出反应①的化学方程式:。
(3)反应③的反应类型为。
(4)反应(填序号)原子的理论利用率为100%,符合绿色化学的要求。
某分子式为C10H20O2的酯,在一定条件下可发生如图所示的转化过程: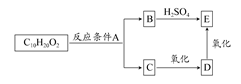
则符合上述条件的酯的结构可有( )
| A.2种 | B.4种 | C.6种 | D.8种 |
为测定某有机化合物A的结构,进行如下实验。
【分子式的确定】
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4 g H2O和8.8 g CO2,消耗氧气6.72 L(标准状况下)。则该物质中各元素的原子个数比是;
(2)质谱仪测定该有机化合物的相对分子质量为46,则该物质的分子式是;
(3)根据价键理论,预测A的可能结构并写出结构简式:。
【结构式的确定】
(4)经测定,有机物A分子内有3种氢原子,则A的结构简式为。
【性质实验】
(5)A在一定条件下脱水可生成B,B可合成包装塑料C,请写出B转化为C的化学反应方程式:。
(6)体育比赛中当运动员肌肉扭伤时,队医随即用氯乙烷(沸点12.27℃)对受伤部位进行局部冷冻麻醉。请用B选择合适的方法制备氯乙烷,要求原子利用率为100%,请写出制备反应的方程式:。
(7)A可通过粮食在一定条件下制得,由粮食制得的A在一定温度下密闭储存,因为发生一系列的化学变化而变得更醇香。请写出最后一步反应的化学方程式:。
如图为硬脂酸甘油酯在碱性条件下水解的装置。进行皂化反应时的步骤如下:
(1)在圆底烧瓶中装入7~8 g硬脂酸甘油酯,然后加入2~3 g氢氧化钠、5 mL水和10 mL酒精。加入酒精的作用为。
(2)隔着石棉网给反应混合物加热约10 min,皂化反应基本完成,所得的混合物为(填“悬浊液”、“乳浊液”、“溶液”或“胶体”)。
(3)向所得混合物中加入(填化学式),静置一段时间,溶液分为上下两层,肥皂在层,这个操作称为。
(4)图中长玻璃导管的作用为。
(5)写出该反应的化学方程式。