[化学一选修2:化学与技术](15分)硫酸是无机“三大强酸”之一,是工业生产中最为重要的产品之一,其产量是衡量一个国家无机化工发展水平的重要标志。在化学工业的很多领域都要用到浓硫酸。
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为______,该反应在____(填设备名称)中进行。
(2)有关接触法制硫酸的下列说法中,正确的是____。
| A.二氧化硫的接触氧化在合成塔中发生 |
| B.吸收塔得到的是98. 3%的浓硫酸 |
| C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失2% |
| D.接触室中采取高温是为了提高催化剂的活性和提高SO2的转化率 |
(3)科研工作者开发了制备SO2,再用电化学原理生产硫酸的方法,装置如图: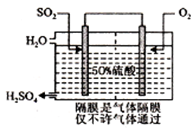
为了稳定技术生产,硫酸的浓度应维持不变,则通入的SO2和水的质量比为____。
(4)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是____。
(5)硫酸工厂排放的尾气中,含少量二氧化硫。为防止污染大气,在排放前必须进行尾气处理并设法进行综合利用。硫酸工厂排放尾气中的SO2通常用足量石灰水吸收,然后再用稀硫酸处理。
①请写出这种尾气处理方法的优点(写出两点即可):
②若某硫酸厂每天排放的1万立方米(标准状况)尾气中含0.2%(体积分数)的SO2,通过上述方法处理,理论上需生石灰____kg。
A、B、C、D、E、F 六种物质有如下变化关系,E是淡黄色粉末,判断: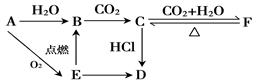
(1)写出下列物质的化学式:
A._____ _____; D.____________ ;
(2)写出有关反应的化学方程式(是离子反应的直接写离子方程式)
B―→C:_____________________________________
E―→B:________________________________________
C―→F:_________________________________________
F―→C:_____________________________________
某学校附近的化工厂排出的污水中因含某些金属离子对水质和环境造成了污染。该校环境保护研究小组的同学对该厂排出的污水取样过滤,对滤液进行了多次检测,其中有三次检测的结果如下表所示。试回答: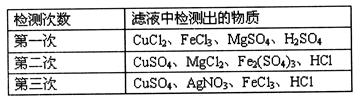
(1)三次检测的结果中第________次检测的结果不正确。
(2)研究小组根据检测结果,向化工厂提出建议:用一种含钠离子的化合物来处理污水,就可以同时除去检测出的金属离子。这种化合物_____________。
(3)在检测时,为了确定滤液中是否存在硫酸根离子和氯离子,同学们将滤液酸化后,首先向滤液中加入过量的_________溶液,将反应后的化合物过滤,再向得到的滤液中加入___________溶液。
⑴Na2CO3固体中混有少量NaHCO3杂质,除去杂质的方法是,反应的化学方程式为
⑵若NaHCO3溶液中混有少量Na2CO3杂质,除去杂质的方法是。
如何鉴别一种白色固体粉末是碳酸氢钠还是碳酸钠?(步骤、现象、结论)
_______________________________________________________________。
(本题6分)
⑴电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
①检验溶液中Fe3+存在的试剂是 __,证明Fe3+存在的现象是 __。[来]②写出FeCl3溶液与金属铜发生反应的化学方程式:。
⑵ 3Cl2+ 6NaOH ="=" 5NaCl + NaClO3+ 3H2O
氧化剂与还原剂的物质的量之比为,氧化产物是 ________。