某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出晶体的是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。Ba(ClO)2可溶于水。
利用下图所示装置进行实验。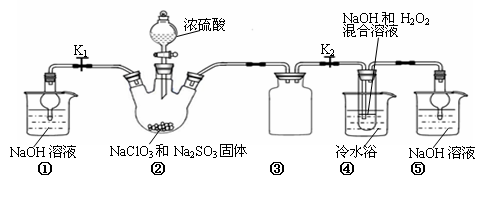
(1)装置①的作用是 装置③的作用是 。
(2)装置②中产生ClO2的化学方程式为 。
(3)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:
①减压,55℃蒸发结晶;②趁热过滤;③ ;④低于60℃干燥,得到成品。
(4)设计实验检验所得NaClO2晶体是否含有杂质Na2SO4,操作与现象是:取少量晶体溶于蒸馏水, 。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,用c mol•L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
(5)滴定中使用的指示剂是 ,达到滴定终点时的现象为 。
(6)样品中NaClO2的质量分数为 (用含m、c、V的代数式表示,式量:NaClO2 90.5)。
Ⅰ.实验室常见的几种气体发生装置如图A、B、C所示:
(1)实验室可以用B或C装置制取氨气,如果用B装置制取氨气其化学反应方程式为。
(2)气体的性质是选择气体收集方法的主要依据。下列性质与收集方法无关的是___________(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
(3)若用A装置与D装置相连制取并收集X气体,则X可以是下列气体中的________。
①CO2②NO③Cl2④H2⑤HCl
其中在D装置中连接小烧杯的目的是____________________。
Ⅱ.某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验 。
(1)经测定,样品X中钴、氨和氯的物质的量之比为1∶6∶3,钴的化合价为________,制备X的化学方程式为______________________________________;
(2)氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL cl mol·L-1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。
氨的测定装置(已省略加热和夹持装置)
①装置中安全管的作用原理是__________________________________________。
②样品中氨的质量分数表达式为________。
草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为:
【提出假设】假设1: 该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是。
【设计、完成实验】
(1)称取g草酸晶体(H2C2O4·2H2O),配置500 mL 0.10 mol/L H2C2O4溶液。
①在上述过程中必须用到的2种定量仪器是托盘天平和。
②下列操作会使所配溶液浓度偏低的是(填下列选项的字母序号)。
| A.称取草酸晶体时,将草酸晶体放在托盘天平右盘 |
| B.定容时俯视刻度线 |
| C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水 |
| D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容 |
(2)完成探究,记录数据
| 实验 编号 |
烧杯中所加试剂及用量(mL) |
控制条件 |
溶液褪[色时间[(s) |
|||
| 0.10 mol/L H2C2O4溶液 |
等浓度 KMnO4溶液 |
H2O |
0.50 mol/L 稀硫酸 |
|||
| 1 |
30 |
20 |
30 |
20 |
18 |
|
| 2 |
30 |
20 |
30 |
20 |
水浴控制温度65 ℃ |
15 |
| 3 |
30 |
20 |
30 |
20 |
加入少量MnSO4固体 |
3.6 |
| 4 |
30 |
20 |
x |
20 |
加入5 mL 0.10 mol/L K2SO4溶液 |
18 |
则x =,假设2成立
(3)由于KMnO4能氧化水中有机物等因素,为配制好稳定的KMnO4溶液,其浓度需标定。取10.00 mL 0.10 mol/L H2C2O4溶液于锥形瓶中,加入10 mL 0.50 mol/L稀硫酸,用(2)中KMnO4溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗KMnO4溶液40.00 mL,则草酸溶液与酸性KMnO4溶液反应的离子方程式为:。上述实验中KMnO4溶液的物质的量浓度为。
(16分)利用明矾石(主要成分:K2SO4·Al2(SO4)3·2Al2O3·6H2O,少量杂质Fe2O3)制备氢氧化铝的流程如下图所示:
(1)焙烧炉中反应为:2Al2(SO4)3+3S=2Al2O3+9SO2;该反应的氧化剂及被氧化的元素分别是:;若生成1 mol Al2O3,则转移电子数是个;
(2)熟料溶解时的离子方程式:。
(3)检验废渣中含有Fe2O3所需的试剂:。所观察到的现象为。
(4)母液中溶质的主要成分的化学式为:;溶液调节pH后经过滤、洗涤可得Al(OH)3沉淀,证明沉淀洗涤干净的实验操作和现象是:。
(14分)半导体生产中常需要控制掺杂,以保证控制电阻率。三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)
已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5 PCl3遇水会强烈水解生成 H3PO3和HC1。遇O2会生成POCl3,POCl3溶于PCl3,PCl3、POCl3的熔沸点见下表:
| 物质 |
熔点/℃ |
沸点/℃ |
| PCl3 |
-112 |
75.5 |
| POCl3 |
2 |
105.3 |
请回答下列问题:
(1)A装置中制氯气的离子方程式为。
(2)B中所装试剂是,
E中冷水的作用是,
F中碱石灰的作用是____。_
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷。通干燥CO2的作用是 。
(4)粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后.通过_____(填实验操作名称),即可得到较纯净的PCl3。
(5)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00 g产品,加水反应后配成250 mL溶液;
②取以上溶液25.00 mL,向其中加入10.00 mL 0.1000 mol·L-1碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol·L-1的Na2S2O3,溶液滴定②重复②、③操作,平均消耗Na2S2O3,溶液8.40 mL
已知:H3PO3+H2O+I2 =H3PO4+2HI,I2+2Na2S2O3 = 2NaI+Na2S4O6,假设测定过程中没有其他反应。根据上述数据,该产品中PC13的质量分数为_______。
工业上用难溶于水的碳酸锶(SrCO3)粉末为原料(含少量钡和铁的化合物)制备高纯六水氯化锶晶体(SrCl2·6H2O),其过程为:
已知:Ⅰ.有关氢氧化物沉淀的pH:
| 氢氧化物 |
Fe(OH)3 |
Fe(OH)2 |
| 开始沉淀的pH |
1.5 |
6.5 |
| 沉淀完全的pH |
3.7 |
9.7 |
Ⅱ.SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
(1)操作①需要加快反应速率,措施有充分搅拌和(写一种)。
碳酸锶与盐酸反应的离子方程式。
(2)在步骤②-③的过程中,将溶液的pH值由1调节至;宜用的试剂为。
A.1.5
B.3.7
C.9.7
D.氨水
E.氢氧化锶粉末
F.碳酸钠晶体
(3)操作③中所得滤渣的主要成分是(填化学式)。
(4)工业上用热风吹干六水氯化锶,适宜的温度是
A.50~60℃B.80~100℃C.100℃以上
(5)步骤⑥宜选用的无机洗涤剂是。