下列实验叙述或现象描述正确的是
| A.液溴易挥发,在存放液溴的试剂瓶中应加水封 |
| B.常温下用铝制品贮运浓硫酸,常温下也可用钢瓶贮存干燥的Cl2,因为互相不发生反应 |
| C.日用铝制品表面覆盖着氧化膜,对内部金属起保护作用;在空气中,镀锌铁板比铁板更耐腐蚀 |
| D.高温下用焦炭还原SiO2制取粗硅;二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
下列说法不正确的是
| A.催化剂的使用,可以降低反应的温度,起到节能的效果 |
| B.陶瓷刀大多是用一种纳米材料“氧化锆”为原料加工而成,具有硬度高、导热性好、抗腐蚀等优点 |
| C.石墨烯是一种由碳原子构成的单层片状结构的新材料,因此具有巨大的表面积,通过穿透式电子显微镜可用于直接观测单原子的吸附和释放过程 |
| D.推进脱硫、脱硝、除尘等设施改造,能大量减排SO2、NO2、PM2.5,使天空重现“APEC蓝” |
已知:2Fe2++Br2===2Fe3++2Br-,2Fe3++2I-===2Fe2++I2。向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如下图所示。下列有关说法中,不正确的是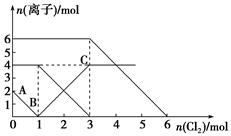
| A.还原性:I->Fe2+>Br- |
| B.原混合溶液中FeBr2的物质的量为6 mol |
| C.当通入2 mol Cl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2===2Fe3++I2+4Cl- |
| D.原溶液中:n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3 |
某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是
| A.正极反应为Ag-e-=Ag+ |
| B.放电时,交换膜右侧溶液中有大量白色沉淀生成 |
| C.当电路中转移0.1mol e-时,通过交换膜的阳离子为0.2mol |
| D.用KCl溶液代替盐酸,则电池总反应不改变 |
阿伏加德罗常数用NA表示,下列叙述正确的是
①22g T2O含有电子数为10 NA
②0.44gC3H8中含有的σ键总数目为0.1NA
③1 mol Na2O2与CO2完全反应时转移电子数为2NA
④28 g 硅晶体中含有2 NA个Si—Si键
⑤11.2LCl2通入足量氢氧化钠溶液中充分反应,转移的电子数等于0.5NA
⑥200 mL,1 mol/L Al2(SO4)3溶液中,Al3+和SO42-离子数的总和是NA
⑦在常温常压下,0.1mol铁与0.1mol Cl2充分反应,转移的电子数为0.3 NA
⑧O2和O3的混合物共6.4g,其中所含原子数一定为0.4 NA
| A.①②③⑤⑧ | B.②④⑥⑦⑧ | C.①③⑤⑥⑦ | D.①②④⑧ |
下列有关溶液中微粒的物质的量浓度关系正确的是
A.某弱酸的酸式盐NaHA溶液中一定有:c(OH﹣)+2c(A2﹣)=c(H+)+c(H2A)
B.0.1 mol•L﹣1 CH3COONa溶液与0.05 mol•L﹣1盐酸等体积混合后的酸性溶液中:c(Cl﹣)>c(CH3COO﹣)>c(CH3COOH)>c(H+)
C.物质的量浓度相等的HCN溶液和NaCN溶液等体积混合后的溶液中:c(CN﹣)+2c(OH﹣)=2c(H+)+c(HCN)
D.0.1 mol•L﹣1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3•H2O)+c(Fe2+)="0.3" mol•L﹣1