已知A、B、C、D、E是短周期元素,原子序数依次增大。其中A、E的单质在常温下呈气态,B的原子最外层电子数是其电子层数的2倍,C在同周期主族元素中原子半径最大,D的合金是常用的金属材料。下列说法正确的是
A.B位于元素周期表中第二周期第VIA族
B.工业上常用热还原法制备C、D、E的单质
C.C、D的最高价氧化物对应的水化物之间能发生化学反应
D.化合物AE与CE具有相同类型的化学键
关于Na2CO3和NaHCO3性质的有关叙述正确的是()
| A.在水中溶解性:Na2CO3<NaHCO3 |
| B.热稳定性:Na2CO3<NaHCO3 |
| C.与酸反应的速度:Na2CO3<NaHCO3 |
| D.Na2CO3不能转化成NaHCO3,而NaHCO3能转化为Na2CO3 |
下列说法不正确的是()
| A.水晶、玛瑙、石英的主要成分都是SiO2 |
| B.CO2通入水玻璃中可以得到硅酸沉淀 |
| C.提前建成的三峡大坝使用了大量水泥,水泥是硅酸盐材料 |
| D.高纯度的硅单质广泛用于制作光导纤维 |
CaC2晶体的晶胞结构与NaCl晶体的相似(如下图所示),但CaC2晶体中含有的中哑铃形C22-的存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法中不正确的是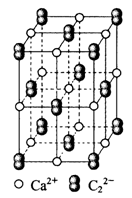
| A.1个Ca2+周围距离最近且等距离的C22-数目为6 |
| B.该晶体中的阴离子与F2是等电子体 |
| C.6.4克CaC2晶体中含阴离子0.1mol |
| D.与每个Ca2+距离相等且最近的Ca2+共有12个 |
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
| A.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。 |
| B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。 |
| C.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。 |
| D.氨气分子是极性分子而甲烷是非极性分子。 |
氰气分子式为(CN)2,结构式为N≡C—C≡N,性质与卤素相近。下列叙述不正确的是
| A.在一定条件下可与乙烯加成 |
| B.分子中C—C大于C≡N的键长 |
| C.不和氢氧化钠溶液发生反应 |
| D.氰气中既有σ键又有π键 |