铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ.铁矿石中含氧量的测定
①按上图组装仪器,检查装置的气密性;
②将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
③从左端导气管口处不断地通入H2,待C装置出口处H2验纯后,再点燃A处酒精灯
④充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)装置C的作用为 。
(2)测的反应后装置B增重1.35g,则铁矿石中氧的百分含量为 。
Ⅱ.铁矿石中含铁量的测定
(1)步骤④中煮沸的作用是 。
(2)步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、 。
(3)下列有关步骤⑥的操作中说法正确的是 。
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作指示剂
c.滴定管用蒸馏水洗涤后可直接装液
d.锥形瓶不需要用待测液润洗
e.滴定过程中,眼睛注视滴定管中液面变化
f.滴定结束后,30s内溶液不恢复原来的颜色再读数
(4)若滴定过程中消耗0.5000mol·L−1KI溶液20.00mL,则矿石中铁的百分含量为 。若省去步骤④,则所测铁的百分含量将 。(偏大,偏小或无影响)
Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为 。
中和滴定实验⑴取体积相同(25mL)的两份 溶液,将其中一份放在空气中一段时间后,溶液的pH(填“增大”“减小”或“不变”)其原因是。用已知浓度的盐酸中和上述两份溶液。若中和放在空气中一段时间后的那份溶液消耗盐酸的体积为
溶液,将其中一份放在空气中一段时间后,溶液的pH(填“增大”“减小”或“不变”)其原因是。用已知浓度的盐酸中和上述两份溶液。若中和放在空气中一段时间后的那份溶液消耗盐酸的体积为 ,中和另一份溶液消耗盐酸的体积为
,中和另一份溶液消耗盐酸的体积为 ,则(1)以甲基橙为指示剂
,则(1)以甲基橙为指示剂 和
和 的关系是。(2)以酚酞为指示剂时,
的关系是。(2)以酚酞为指示剂时, 和
和 的关系是。
的关系是。
⑵某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作()
| A.在250mL的容量瓶中定容配成250mL烧碱溶液 |
| B.用移液管移取25mL烧碱溶液于锥形瓶中并滴几滴指示剂甲基橙 |
| C.在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解 |
| D.将物质的量浓度为C的标准硫酸溶液装入酸式滴定管,调节液面,记下开始读数为V1 |
E. 在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:(1)正确操作步骤的顺序是(用字母填写)→→→ D →。
(2)滴定管的读数应注意。
(3)E中在锥形瓶下垫一张白纸的作用是。(4)D步骤中液面应调节到,尖嘴部分应。
(5)滴定终点时锥形瓶内溶液的pH约为,终点时颜色变化是。
(6)若酸式滴定管不用标准硫酸润洗,在其它操作均正确的前提下,会对测定结果(指烧碱的纯度)有何影响?(指偏高、低或不变)(7)该烧碱样品纯度的计算式为。
(15分)工业上将纯净干燥的氯气通入到物质的量浓度为0.375 mol·L-1NaOH溶液中得到漂白水。某同学想在实验室探究Cl2性质并模拟制备漂白水,下图是部分实验装置。已知KMnO4与盐酸溶液反应可以制取Cl2。
(1)配制物质的量浓度为0.375 mol·L-1NaOH溶液100mL时, 用托盘天平称取所需的NaOH质量为 。
(2)浓硫酸的作用是 。
(3)装置E中发生化学反应方程式为 。
(4)装置B中饱和NaCl溶液的作用是。
(5)实验时装置D中湿润的红色纸条褪色,干燥部分没有褪色,放置一段时间后,纸条全部褪色。该同学认为Cl2的密度比空气大,可能是试管下部Cl2的浓度大于试管上部Cl2的浓度所导致的。请判断该解释是否合理,并分析产生上述实验现象的原因
;如需改进,请简述设计方案 (若认为合理。则此问可不作答)。
(6)氯元素含量为10%的漂白水溶液355g,其中含NaClO的物质的量为 mol。
(13分)实验室要配制1 mol·L-1的稀硫酸250mL,回答下列问题:
(1)需要98%密度为1.84g/cm3的浓硫酸 mL
(2)配制时,必须使用的仪器有 (填代号)
①烧杯 ②100 mL量筒 ③20 mL量筒 ④1000 mL容量瓶 ⑤250 mL容量瓶 ⑥托盘天平(带砝码) ⑦玻璃棒还缺少的仪器是 。
(3)配制时,该实验两次用到玻璃棒,其作用分别是 、 。
(4)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不影响”)
①没有洗涤烧杯和玻璃棒。 。
②如果加水超过了刻度线,取出水使液面恰好到刻度线。 。
③容量瓶没有干燥。
④定容时俯视容量瓶瓶颈刻度线
(1)向KAl(SO4)2溶液中滴加过量氨水,现象是____________________________,反应的离子方程式______________________________________________,再向其中加入过量NaOH溶液,反应现象是____________________________________________,反应的离子方程式为_______________________________________________。
(2)下列六个图中,横坐标为某溶液中加入某物质的物质的量,纵坐标为生成沉淀的物质的量,请把下表中各反应的相应图象的序号填入表中。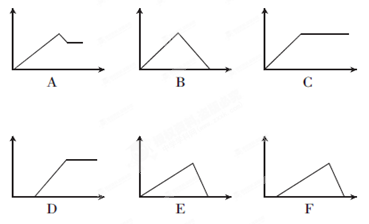
| 溶液 |
加入的物质 |
答案序号 |
| ①饱和石灰水 |
通过量CO2 |
|
| ②AlCl3溶液 |
通过量NH3 |
|
③MgCl2、AlCl3混合溶 液 液 |
逐滴加NaOH溶液至过量 |
|
| ④AlCl3溶液 |
逐滴加NaOH溶液至过量 |
|
| ⑤含少量HCl的AlCl3溶液 |
逐滴加NaOH溶液至过量 |
.某学生课外活动小组,模拟呼吸面具中的反应原理,设计用下图所示的仪器来制取氧气并测量氧气的体积。图中量气装置E由甲、乙两根玻璃管组成,它们由橡皮管连通,并装入适量水。甲管有刻度(0—50 mL),供量气用;乙管可上下移动调节液面高低。
实验可供选用的药品还有:稀硫酸、盐酸、过氧化钠、碳酸钠、大理石、水。
试完成下列问题:
(1)图中各装置接口连接顺序是_____(填各接口的编号,其中连接胶管及夹持装置均省略)。
(2)装置C中放入的反应物是__________和__________。
(3)装置D中发生的化学反应方程式
(4)装置A的作用是___________________________________________________________,装置B的作用是___________________________________________________________。
(5)为了较准确测量氧气的体积,除了必须检查整个装置的气密性之外,在读反应前后甲管中液面的读数及求其差值的过程中,应注意__________和__________(填字母编号)。
a.视线与凹液面最低处相平 b.等待片刻,待乙管中液面不再上升时立刻读数
c.读数时应上下移动乙管,使甲、乙两管液面相平 d.读数时不一定使甲、乙两管液面相平
(6)反应结束后,测得产生的气体标准状况下体积为22.4 mL,则反应过程中转移的电子数目为。