某种氧化铜样品中混有少量木炭粉,为测定该样品中氧化铜的质量分数,某同学设计了如下装置进行实验(N2不参加反应,不考虑外界空气对实验的影响)。
①该实验需要测定的量:反应前后装置Ⅱ的质量和 (9) 的质量
②充分反应后,装置Ⅱ的质量增加了0.44 g,则生成的二氧化碳的物质的量是 (10) mol。求参加反应的氢氧化钠的物质的量。(请根据化学方程式列式计算) (11)
③为达到实验目的,对反应前氢氧化钠溶液中溶质质量的要求是 (12) g。
④关于该实验的下列说法正确的是(13) 。
| A.当黑色粉末全部变为光亮红色时方可停止加热 |
| B.实验结束时先熄灭酒精喷灯会导致Ⅱ中液体倒流入Ⅰ中 |
| C.只称量反应前后装置Ⅰ中固体质量也可达到实验目的 |
| D.用氧气代替氮气完成实验也可达到实验目的 |
硫酸亚铁铵晶体俗称摩尔盐,化学式为FeSO4·(NH4)2SO4·6H2O,在制药、电镀方面有广泛的应用。某化学兴趣小组的学生用含有少量铜的废铁屑制备硫酸亚铁铵晶体,流程如下:
资料:①硫酸亚铁铵晶体易溶于水,不溶于酒精;硫酸亚铁铵晶体在100℃~110℃时分解。
②相关物质的溶解度(单位:g)如下表:
| 温度/℃ |
FeSO4 |
(NH4) 2SO4 |
FeSO4·(NH4)2SO4·6H2O |
| 10 |
20.0 |
73 |
17.2 |
| 20 |
26.5 |
75.4 |
21. 6 |
| 30 |
32.9 |
78 |
28.1 |
请回答下列问题:
(1)实验前,先用碳酸钠溶液浸泡废铁屑表面油渍。碳酸钠溶液可除去油渍是因为碳酸钠溶液的pH7(选填“>”、“<”或“=”)。
(2)①中发生反应的化学方程式为。
(3)操作①中过滤时,要趁热进行的原因是,过滤后得到的固体中一定含有的物质是。
(4)操作③中使用无水酒精洗涤,可快速晾干。这样做的优点是(填字母)。
A.避免用水洗涤所造成的晶体损耗
B.酒精易挥发,可低温晾干晶体
根据下列实验装置图,回答有关问题。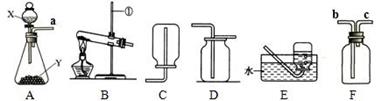
(1)图中标有①的仪器名称是。
(2)实验室用氯酸钾和二氧化锰制氧气,反应的化学方程式为,应选择的发生装置是。若要获得较纯净氧气,应选择的收集装置是(选填“C”、“D”或“E”)。将点燃的硫粉伸入盛满氧气的集气瓶中,观察到火焰。
(3)实验室用A装置制备氢气,且产生的气体中不含酸性杂质气体,则试剂X常用_____,用F装置收集氢气,导管口a应与______(选填“b”或“c”)相连。
(4)点燃不纯的可燃性气体可能发生爆炸。下图是某同学的两种改进装置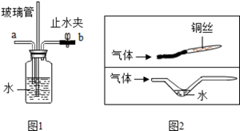
请回答:
①图1是可燃性气体的洗气改进装置,检查它的气密性的方法是:夹住止水夹b,向导管a处通入气体,若观察到的现象是,则装置气密性好;若在导管a处通入可燃性气体,在导管b处连上尖嘴管并松开止水夹,点燃,即使气体不纯也不会爆炸。
②用图2尖嘴管导出可燃性气体并点燃,也不会使管中气体爆炸,其原理是铜丝或水可以。
工业上高温煅烧石灰石制取生石灰,反应的化学方程式为,
反应的基本类型是,生石灰与水反应可以制得熟石灰。硫酸厂的污水中含有硫酸,可用熟石灰〔Ca(OH)2〕进行中和处理,该反应的化学方程式为。
化学就在我们身边,请用所学的化学知识填空。
(1)现有H、O、C、Na四种元素,请选用其中的元素写出下列物质的化学式:
①用于人工降雨或灭火;②制肥皂的碱;
③最清洁的燃料;④治疗胃酸过多的盐。
(2)2015年1月19日投用的无锡机场新航站楼使用了钢架结构。
①钢属于(填“纯净物”或“混合物”)
②铁锈蚀是铁与空气中的水蒸气和(填化学式)等物质共同作用的结果,写出一种日常生活中防止铁制品生锈的方法。
③下图中,可表示金属铁的是。
根据下列实验装置图,回答有关问题。
(1)写出装置图中标号仪器的名称:甲,乙。
(2)实验室用大理石和稀盐酸制取二氧化碳的化学方程式为,选用D装置收集二氧化碳的原因是。
(3)实验室用高锰酸钾制取氧气的化学方程式为。实验室选用装置A与E制取氧气,实验步骤如下:
①先检验装置的气密性,再加入药品;
②先让试管均匀受热,再对药品所在的部位加热;
③导管口开始有气泡放出后,立即收集;
④停止加热时,先熄灭酒精灯,再把导管移出水面。
以上实验步骤正确的是(填序号)。