[化学---物质结构与性质]
氟在自然界中常以CaF2的形式存在。
(1)下列关于CaF2的表述正确的是_______。
a.Ca2+与F-间仅存在静电吸引作用
b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
c.阴阳离子比为2:1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是________(用离子方程式表示)。
已知AlF63-在溶液中可稳定存在。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为______________,其中氧原子的杂化方式为_________。
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)=2ClF3(g) △H=-313kJ·mol-1,F-F键的键能为159kJ·mol-1,Cl-Cl键的键能为242kJ·mol-1,则ClF3中Cl-F键的平均键能为______kJ·mol-1。ClF3的熔、沸点比BrF3的________(填“高”或“低”)。
、现有下列物质:①H2S、②NH3、③H2SO4、④NaHCO3、
⑤CH3COOH、⑥KNO3溶液、⑦盐酸、⑧酒精、⑨二元酸H2A等。请回答下列问题(请填入序号)。
(1)其中一定属于弱电解质的是。不能确定的是,请设计一个实验以证明它是强电解质还是弱电解质。你的实验和结论是
;
(2)H2S在水中的电离方程式为__________;
NaHCO3在水中的电离方程式为; 已知H2A的电离方程式为:H2A ="=" H++HA-; HA-H++A2-。试判断H2A是电解质(填“强”或“弱”)。
已知H2A的电离方程式为:H2A ="=" H++HA-; HA-H++A2-。试判断H2A是电解质(填“强”或“弱”)。
(3)2mol/L的盐酸和2mol/L的醋酸各100ml,分别与过量的Zn反应,生成H2的体积,V(盐酸)V(醋酸)(填>、=或<);氢离子浓度相等的盐酸和醋酸各100ml,分别与过量的Zn反应,生成H2的体积V(盐酸)V(醋酸) (填>、=或<);理由是
; (4)已知CH3COO-+H+ CH3COOH;现要使平衡向右移动且氢离子浓度增大,应采取的措施是()
(4)已知CH3COO-+H+ CH3COOH;现要使平衡向右移动且氢离子浓度增大,应采取的措施是()
| A.加NaOH | B.加盐酸 | C.加水 | D.升高温度 |
已知CH3COOH在溶剂A中可以全部电离,盐不溶解于A溶剂。则CH3COOH在溶剂A中的电离方程式为;CH3COOH和Na2CO3在溶剂A中生成CO2反应的离子方程式是。
完成下列化学方程式或离子反应方程式:
(1)葡萄糖与银氨溶液水浴加热反应的化学方程式:
_______________________________________________________________;
(2)氢氧化铝和氢氧化钠溶液反应的离子方程式:
________________________________________________________________。
(1)维生素C的结构简式为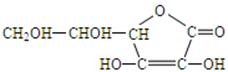
请回答:①维生素C的分子式是
②向维生素C的水溶液中滴加紫色石蕊试液,试液变红,说明维生素C的水
溶液显 性。
性。
(2)一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。维生素C在这一反应中具有性;维 生素C又称为。
生素C又称为。
合金与各成分的金属相比,其特点为硬度比纯金属___ _____,熔点比比各成分金属 _____________。
_____,熔点比比各成分金属 _____________。
人的血液呈 (酸性,弱酸性,中性,碱性,弱碱性),我国居民形成了摄入蔬菜和水果偏少的习惯,一般尿液呈 性(偏酸,中性,偏碱)。