小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3·10H2O),为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如下装置进行实验。
实验过程:
Ⅰ、按图组装仪器,检查装置的气密性;
Ⅱ、将试样m1g放入硬质玻璃管中,装置B、C、D中药品如图,已知加药品后装置B的质量为m2 g、装置C的质量为m3 g;
Ⅲ、关闭活塞a,点燃酒精灯加热试样,直到B装置中无气泡冒出后,打开活塞a向装置中通入N2,一段时间后,撤掉酒精灯,关闭活塞a;
Ⅳ、称得装置B的质量为m4 g、装置C的质量为m5 g。
请回答以下问题(装置中原有空气对实验的影响忽略不计):
(1)装置A中发生反应的化学方程式为 , 。
(2)装置C的作用为 。装置D的作用为 。
(3)实验过程中通入N2的目的为 。
(4)用下列各项所提供的数据能计算出w(NaHCO3)的是 (填选项字母)
| 序号 |
a |
b |
c |
d |
e |
| 数据 |
 、 、 、 、 |
 、 、 、 、 、 、 |
 、 、 、 、 |
 、 、 、 、 |
 、 、 、 、 |
(5)实验结束后发现装置A中硬质玻璃管右端有水珠,你认为利用实验中所提供的数据还能否得到准确的w(NaHCO3),若能,则w(NaHCO3)的计算式为: (若不能,此问不作答。)
(共11分)如图为某化学兴趣小组进行丁烷裂解的实验流程。(注:CuO能将烃氧化成CO2和H2O,G后面装置与答题无关,省略。)
按图连接好装置后,需进行的实验操作有:①给D、G装置加热;②检查整套装置的气密性;③排出装置中的空气……
(1)这三步操作的先后顺序依次是 。
(2)简要说明排空气的方法和证明空气已排尽的方法 。
(3)B装置所起的作用是 。
(4)若对E装置中的混和物再按以下流程实验:
①分离操作I、II的方法是:I ,II 。
②Na2SO3溶液的作用是(用离子方程式表示)
。
(5)假定丁烷完全裂解,流经各装置中的气体能完全反应。当(E和F)装置的总质量比反应前增加了1.82g,G装置中固体质量减少了4.16g,则丁烷的裂解产物中:n(CH4):n(C2H6)=
维生素C是一种水溶性维生素(化学式为C6H8O6其水溶液呈酸性),人体缺乏这样的维生素会得坏血症,所以维生素C又称抗坏血酸。在新鲜的水果、蔬菜、乳制品中都富含维生素C,例如新鲜橙汁中维生素C的含量在500mg/L左右。某校课外活动小组测定了某牌子的软包装橙汁中维生素C的含量,下面是测定实验分析报告。(请填写有关空白)
(一)测定目的:测定××牌软包装橙汁中维生素C的含量。
(二)测定原理:C6H8O6+I2 →C6H6O6+2H++2I―
(三)实验用品及试剂
(1)仪器和用品(自选,略)
(2)试剂:指示剂___ ▲____(填名称),浓度为7.50×10-3mol·L-1的I2标准溶液、蒸馏水等。
(四)实验过程
(3)洗涤仪器,检查滴定管是否漏液,润洗后装好标准碘溶液待用。
(4)用 ▲ (填仪器名称)向锥形瓶中移入20.00mL待测橙汁,滴入2滴指示剂。
(5)用左手控制滴定管的__ ▲_____(填部位),右手摇动锥形瓶,眼睛注视___ ▲____,直到滴定终点。滴定至终点时的现象是______ ▲________。
(五)数据记录与处理
若经数据处理,滴定中消耗标准碘溶液的体积是15.00mL,则此橙汁中维生素C的含量是_▲mg/L。
(六)问题讨论:
(1)滴定时能否剧烈摇动锥形瓶? ▲,为什么? _____ ▲_________。
(2)从分析数据看,此软包装橙汁是否是纯天然橙汁?___ ▲____(填“是”或“不是”或“可能是”)。制造商最可能采取的做法是____ ▲______(填编号):
A.加水稀释天然橙汁 B.橙汁已被浓缩 C.将维生素C作为添加剂
:草酸晶体的组成可用H2C2O4·xH2O表示,为了测定x值,进行如下实验:
称取Wg草酸晶体,配成100.00mL水溶液
(1)量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol·L-1的KMnO4溶液滴定到KMnO4不再褪色为止,所发生的反应
2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
试回答:(1)实验中不需要的仪器有(填序号)___________,还缺少的仪器有(填名称)___________________________________________________。
a.托盘天平(带砝码,镊子)b.滴定管 c.100mL量筒 d.100mL容量瓶 e.烧杯 f.漏斗 g.锥形瓶 h.玻璃棒 i.药匙 j.烧瓶
(2)实验中,标准液KMnO4溶液应装在_____式滴定管中,因为_______________。
(3)若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得的x值会__________________________(偏大、偏小、无影响)
(4)在滴定过程中若用amol·L-1的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为________________________mol·L-1,由此可计算x的值是____________。
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室用无水乙醇与乙酸制备乙酸乙酯的化学方程式如下:
CH3COOH+C2H5OH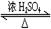 CH3COOC2H5+H2O
CH3COOC2H5+H2O
(1)该反应的平衡常数表达式K= 。
(2)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用右图所示装置进行了以下四个实验,实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
| 实验 编号 |
试管Ⅰ中的试剂 |
试管Ⅱ中试剂 |
测得有机层的厚度/cm |
| A |
2mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 |
饱和碳酸钠溶液 |
5.0 |
| B |
3mL乙醇、2mL乙酸 |
0.1 |
|
| C |
3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 |
1.2 |
|
| D |
3mL乙醇、2mL乙酸、盐酸 |
1.2 |

①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是mL和mol/L。
②分析实验(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是。
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是。
空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
(1)步骤①中用硫酸酸化可提高Cl2的利用率,为什么?。
(2)步骤④的离子方程式:________________________________________。
(3)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离,分离仪器的名称是_____________
(4)提取时要经过“空气吹出、SO2吸收、氯化”的过程的目的是:。