(1)Cu2+能与NH3、Cl-等形成配位数为4的配合物,已知[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为 。
(2)下图是铜的某种氧化物的晶胞结构示意图,该晶体的密度为a g/cm3,设阿伏伽德罗常数的值为NA,则该晶胞的体积为 cm3
(3)0.01mol氯化铬晶体(CrCl3·6H2O)在水溶液中用过量的AgNO3溶液处理,产生0.02molAgCl沉淀,此氯化铬晶体最可能为
a.[Cr(H2O)6] Cl3 b.[Cr(H2O)5 Cl] Cl2·H2O
c.[Cr(H2O)4Cl2] Cl·2H2O d.[Cr(H2O)3Cl3]·3H2O
(4)CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5]、羰基镍[Ni(CO)4]。其中Fe(CO)5常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于
(填晶体类型)。CO与N2 互为等电子体,与CO互为等电子体的离子为 (任写一种);
(5)已知含氧酸可用通式XOm(OH)n来表示,如X是S,当m=2,n=2,则这个式子就表示H2SO4。一般而言,该式中m值大的酸性强,m值小的酸性弱。下列各含氧酸中酸性最强的是
a.HClO2 b.H2SeO3 c.H3BO3 d.HMnO4
以下是元素周期表的一部分,回答下列有关问题:
| ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
|
| 4 |
⑩ |
⑾ |
⑿ |
⑴写出⑥的元素符号:,⑧的离子结构示意图,②的单质的电子式,①的氢化物结构式。
⑵在这些元素中,最不活泼的元素是(用元素符号作答)。
⑶在这些元素的最高价氧化物对应的水化物中,酸性最强的是;(用化学式作答,下同)碱性最强的是;呈两性的氢氧化物的是。
⑷在这些元素中,原子半径最大的是(用元素符号作答)。
⑸这些元素中形成的碱性最强的碱与呈两性的氢氧化物恰好反应的离子方程式是
。
A和B反应生成C,假定反应由A、B开始,它们的起始浓度均为1mol/L。反应进行2min后A的浓度为0.8mol/L,B的浓度为0.6mol/L,C的浓度为0.6mol/L。则2min内反应的平均速率VB=__________,该反应的化学反应方程式为____ _______________________。
(1)如图所示,铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号)_______________。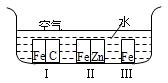
将1体积CH4和4体积Cl2组成的混合气体充入大试管中,将此试管倒立在水槽里,放在光亮处。片刻后发现试管中气体颜色,试管中液面上升,试管壁上出现了,在该反应的所有产物中(HCl除外),常温下(填化学式)是气体,空间构型与甲烷完全相同的是(填化学式)。试写出甲烷与氯气反应生成一氯代物的化学反应方程式。
从能量转化的角度看,原电池是一种由_______能转变成________能的装置;用锌片、铜片和稀盐酸组成的原电池,负极是________,正极的电极反应是___________________,正极发生反应(填“氧化”或“还原”)