下列有关化学键的说法正确的是
| A.含有共价键的化合物一定是共价化合物 |
| B.分子中只有共价键的物质一定是共价化合物 |
| C.非金属元素的原子不能形成离子化合物 |
| D.含有离子键的化合物一定是离子化合物 |
已知0.1 mol/L的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中
CH3COO-+H+,要使溶液中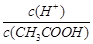 值增大,可以采取的措施是
值增大,可以采取的措施是
| A.加少量烧碱溶液 | B.降低温度 |
| C.加少量冰醋酸 | D.加水 |
已知HCN、CN—在溶液中存在下列平衡及其对应的平衡常数:
①HCN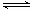 H++CN—△H1>0 K1
H++CN—△H1>0 K1
②CN—+H2O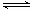 HCN+OH-△H 2>0 K2
HCN+OH-△H 2>0 K2
常温下(K1=6.2×10-10),将等体积、等物质的量浓度的HCN和NaCN溶液混合,下列叙述正确的是
| A.混合溶液的pH<7 |
| B.对混合溶液进行微热,K1增大、K2减小 |
| C.K2≈ 1.6×10-5 |
| D.c(Na+) =" c(HCN)" + c(CN‑) |
将浓度为0.1 mol/L的HF溶液加水不断稀释,下列各量始终保持增大的是
| A.c(H+) | B.Ka(HF) | C.c(F-) | D.c(OH-) |
已知25 ℃时有关弱酸的电离平衡常数如下表:
| 弱酸化学式 |
HF |
HClO |
H2CO3 |
| 电离平衡常数 |
6.8×10-4 |
4.7×10-8 |
K1=4.3×10-7 K2=5.6×10-11 |
下列推断正确的是
A.常温下,同物质的量浓度NaClO与NaHCO3溶液,前者的pH较小
B.若某溶液中c(F—)=c(ClO—),往该溶液中滴入HCl,F-比ClO-更易结合H+
C.往饱和Na2CO3溶液中逐滴加入稀盐酸至过量,所得溶液中c(HCO3—)先增大后减小
D.同温下,等体积、等pH的HF和HClO分别与NaOH完全反应,消耗等量的NaOH
物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是
| A.HX,HZ,HY | B.HX,HY,HZ |
| C.HZ,HY,HX | D.HY,HZ,HX |