(1)下列与化学实验有关的描述错误的是_______ (填序号)。
①燃着的酒精灯不慎碰翻失火,可立即用湿布盖灭
②分液时分液漏斗中的下层液体从下口流出,上层液体从上口倒出
③锥形瓶用作反应容器时一定不能加热
④浓硝酸与浓盐酸均易挥发,故均应保存在棕色试剂瓶中,并置于阴凉处
⑤不慎将浓碱溶液溅到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液
⑥称取10.5 g固体样品(1 g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为9.5g。
(2)某探究小组在实验室中用铝土矿(主要成分为Al2O3,还含有Fe2O3、SiO2)提取氧化铝。
回答下列问题:
(2)①该实验过程中,多次用到玻璃棒,如过滤时引流液体、灼烧时搅拌防止固体崩溅,试写出该实验过程中玻璃棒的第三个作用 。
②验证滤液A含Fe3+,可取少量滤液并加入____________ (填试剂名称)。
③实验中,该小组同学用下图装置进行过滤操作,过滤操作中的一处错误是 。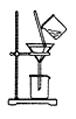
④在灼烧操作时用到下列仪器中的 (填字母代号),其名称是 。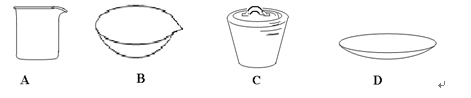
可溶性氯化物中氯含量的测定常采用莫尔法,此法是以K2CrO4为指示剂,用AgNO3标准溶液进行滴定。其实验步骤为:
一、配制0.100mol·L-1AgNO3溶液
准确称取AgNO38.50g,溶于500mL不含氯离子的蒸馏水中,摇匀后,贮存于带玻璃塞的棕色试剂瓶中。
二、0.100mol·L-1AgNO3溶液的标定
准确称取0.585g NaCl于100mL烧杯中,用蒸馏水溶解后,定量转移入100mL容量瓶中,加水稀释至刻度,摇匀。
取所配NaCl溶液25.00mL 3份,分别置于锥形瓶中,加25mL水,1mL 5% K2CrO4溶液,在不断摇动下用AgNO3溶液滴定,至溶液呈砖红色[2Ag++CrO===Ag2CrO4↓(砖红色)]。实验测得三次所耗硝酸银溶液体积的平均值为26.32mL。
三、氯化物试样中氯的测定
准确移取25.00mL氯化物试液3份,分别置于锥形瓶中,加入25mL水,1mL 5% K2CrO4溶液,在不断摇动下用AgNO3标准溶液滴定至溶液呈砖红色。实验测得三次所耗硝酸银溶液的体积的平均值为VmL。
回答下列问题:
(1)NaCl固体使用前,要将其置于坩埚中加热,并用 不断搅拌,以除掉氯化钠晶体中的水。
(2)AgNO3溶液需要标定的主要原因是 。
(3)指示剂CrO在溶液中存在下列的平衡:2H++2CrO 2HCrO
2HCrO Cr2O+H2O,由此判断该滴定适宜的pH值范围可能是 。(填代号)
Cr2O+H2O,由此判断该滴定适宜的pH值范围可能是 。(填代号)
A.1——6.5 B.6.5——10.5 C.10.5——14
(4)用硝酸银滴定氯离子达到化学计量点时,c(Ag+)=c(Cl-),若此时要求不生成Ag2CrO4沉淀,c(CrO)最大不能超过 mol·L-1,因此,实验中对指示剂的浓度有较高的要求。(已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.8×10-12)
(5)CrO的黄色对滴定终点的判断没有影响的原因是 。
(6)AgNO3标准溶液的准确浓度为 mol·L-1,列出计算可溶性氯化物试液中氯元素的含量的式子: g·L-1。
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
(1)煤的气化的主要化学反应方程式为: 。
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)  CH3OH(g) ΔH=-90.8kJ·mol-1
CH3OH(g) ΔH=-90.8kJ·mol-1
②2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-23.5kJ·mol-1
③CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.3kJ·mol-1
CO2(g)+H2(g) ΔH=-41.3kJ·mol-1
写出水煤气直接合成二甲醚同时生成CO2的热化学反应方程式 。
(3)一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是 。
a.高温高压 b.低温低压
c.减少CO2的浓度 d.增加CO的浓度
e.分离出二甲醚 f.加入催化剂
(4)已知反应②2CH3OH(g)  CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| 浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
比较此时正、逆反应速率的大小:v正 v逆(填“>”、“<”或“=”),若上述情况达到平衡,此时c(CH3OH)= 。
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量): 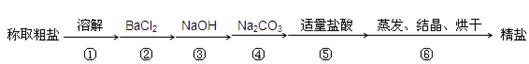
(1)按照该同学设计的实验步骤,并不能得到精盐,原因在于步骤中少了一个操作,该操作是,应加在和之间。
(2)判断BaCl2已过量的方法是()
| A.取②后的上层清液少许放入试管中,再滴入几滴Na2SO4溶液,若溶液未变浑浊,则证明BaCl2已过量。 |
B.取②后的上层清液少许放 入试管中,再滴入几滴BaCl2溶液,若溶液未变浑浊,则证明BaCl2已过量。 入试管中,再滴入几滴BaCl2溶液,若溶液未变浑浊,则证明BaCl2已过量。 |
| C.取②后的上层清液少许放入试管中,再滴入几滴AgNO3溶液,若溶液变浑浊,则证明BaCl2已过量。 |
| D.取②后的上层清液少许放入试管中,再滴入几滴BaCl2溶液,若溶液变浑浊,则证明BaCl2已过量。 |
(3)写出④中相应的离子方程式,。
(1)下列操作会导致实验结果偏高的是

A.配制一定物质的量浓度的硫酸溶液时,定容摇匀后,发现液面低于刻度线。
B.在配制一定物质的量浓度溶液时,用 10 mL的量筒量取5.0 mL液体溶质时俯视读数
C.用天平称量20.5g某物质,砝码和药品的位置放反,所得药品的质量
D.10%的硫酸和90%的硫酸等体积混合配制50%的硫酸溶液
E.配制一定物质的量浓度溶液时,定容时仰视读数,所得溶液的浓度
(Ⅱ )现有下列仪器或用品:a.铁架台(含铁圈、铁夹) b.锥形瓶c.滴定管 d.烧杯(若干) e.玻璃棒 f.胶头滴管 g.托盘天平(含砝码) h.滤纸 i.量筒 j.漏斗 k.温度计。
)现有下列仪器或用品:a.铁架台(含铁圈、铁夹) b.锥形瓶c.滴定管 d.烧杯(若干) e.玻璃棒 f.胶头滴管 g.托盘天平(含砝码) h.滤纸 i.量筒 j.漏斗 k.温度计。
现有下列试剂:A.NaOH固体 B.碳酸钠溶液 C.氯化镁溶液 D.蒸馏水,试填空:
(1)如图分别是温度计、量筒、滴定管的一部分,下述判断及读数(虚线刻度)不正确的是。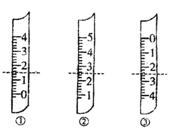
A.①是量简,读数为1.5mL
B.②是量筒,读数为2. 5mL
5mL
C.③是滴定管,读数为2.50mL
D.②是温度计,读数是2.5℃
(2)配制一定物质的量浓度的氢氧化钠溶液时,还缺少的仪器是
(3) 除去 Mg(OH)2中混有的少量 Ca(OH)2,可以用的试剂是:(选填序号),操作方法是、洗涤。完成上述操作,上述仪器或用品用到的有(从上述仪器或用品中选择,并填上相应序号)。
除去 Mg(OH)2中混有的少量 Ca(OH)2,可以用的试剂是:(选填序号),操作方法是、洗涤。完成上述操作,上述仪器或用品用到的有(从上述仪器或用品中选择,并填上相应序号)。
(1)常温下,0.1 mol/L的醋酸和0.1 mol/L的盐酸各100 mL,分别与足量的锌粒反应,产生的气体体积前者后者(填“<”、“>”或“=”).
(2)在25℃条件下将pH=5的氯化铵溶液稀释100倍 ,稀释后溶液的pH为(填选项字母,下同).
,稀释后溶液的pH为(填选项字母,下同).
A.5 B.7 C.3~5之间 D.5~7之间
(3)将体积和物质的量浓度都相同的醋酸和氢氧化钠溶液混合后,溶液呈性(填“酸”,“中”或“碱”,下同),溶液中c(Na+)c(CH3COO-)(填“ >” 或“=”或“<”,下同 )。
(4)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈性,溶液中c(Na+)c(CH3COO-)
(5)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+)氢氧化钠溶液中c(OH-),m与n的大小关系是mn。
(6)用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是。(多选、错选不得分)
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质;
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确;
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗;
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液;
E.未用标准液润洗碱式滴定管。