(1)氢气可由天然气和水反应制备,其主要反应为:
CH4(g)+ 2H2O(g)  CO2(g)+4H2(g)
CO2(g)+4H2(g)
反应过程中能量变化如图所示:
则该反应为 反应(填“吸热”或“放热”)。若已知,破坏1mol化学键需要吸收的热量如下代数式表示:
| 化学键 |
C—H |
O—H |
C=O |
H—H |
| 吸收热量(kJ/mol) |
a |
b |
c |
d |
则根据该反应制取1mol H2要吸收或放出热量为 kJ(用含a b c d字母表示)。
(2)某温度下,10L密闭容器中充入1.8mol CH4和3mol H2O(g),发生CH4+2H2O(g)  CO2+4H2反应,反应进行到8s时CO2的浓度为0.08mol/L,则:
CO2+4H2反应,反应进行到8s时CO2的浓度为0.08mol/L,则:
①前8s以H2O(g)表示的平均反应速率为 ;
②8s时,混合气体中H2的体积分数为 ;
研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为________。
利用反应6NO2+8NH3 7N2+12H2O也可处理NO2。当转移0.4mol电子时,消耗的NO2在标准状况下的体积是______L。
7N2+12H2O也可处理NO2。当转移0.4mol电子时,消耗的NO2在标准状况下的体积是______L。
(2)SO2可用足量的NaOH溶液吸收,该反应的离子方程式为______;若继续通入SO2,当n (SO2): n(NaOH)=1:1时所得溶液呈酸性,下列关系正确的是_____ (填字母编号)。
a. c(Na+)> c(HSO3-)> c(SO32-)
b. c(Na+)+ c(H+)= c(SO32-)+ c(HSO3-)+ c(OH-)
c. c(Na+)= c(SO32-)+ c(HSO3-)
SO2也可用O2氧化生成SO3
已知:①NO2(g)+SO2(g)  SO3(g)+NO(g) ΔH =" -41.8" kJ/mol ;
SO3(g)+NO(g) ΔH =" -41.8" kJ/mol ;
②2NO(g)+O2(g)  2NO2(g)ΔH =" -113.0" kJ/mol ;
2NO2(g)ΔH =" -113.0" kJ/mol ;
则反应2SO2(g)+O2(g)  2SO3(g)ΔH=______ kJ/mol。
2SO3(g)ΔH=______ kJ/mol。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)  CH3OH(g),CO在不同温度下的平衡转化率与压强的关系如图所示。
CH3OH(g),CO在不同温度下的平衡转化率与压强的关系如图所示。
①该反应ΔH______0(填“>”或“<”)。
②若容器容积不变,下列措施可提高CO转化率的是_____。
a.升高温度 b.将CH3OH(g)从体系中分离
c.充入氦气,使体系总压强增大 d.再充入一定量的 CO气体
H、C、N、Cl、Na、Al是常见的六种元素
(1)H位于元素周期表第________周期第________族;C的基态原子核外有_________对成对电子;Cl原子的价电子表示式________.
(2)用“>”、“=”、“<”填空
| 稳定性 |
得电子能力 |
离子半径 |
电负性 |
| CH4____NH3 |
1H_____2H |
Na+_____Al3+ |
C____Al |
(3)用电子式表示NaCl的形成过程:__________________________________________.
(4)已知在常温常压下:
| 化学键 |
H—H |
H—Cl |
Cl—Cl |
| 键能kJ/mol |
a |
b |
c |
写出H2与Cl2反应的热化学方程式:_________________________________________.
[化学一选修3:物质结构与性质](15分)A、B、C、D、E五种元素是周期表中前四周期的元素。只有A、B、C为金属且同周期,原子序数A<B<C。A、C核外均没有未成对电子;B原子核外有二个未成对电子和三个空轨道。D原子最外层电子数是其周期序数的三倍。E能与D形成化合物ED2,可用于自来水的消毒。
(1)C的基态原子的价层电子排布式为;D和E的电负性大小关系为(用元素符号表示)。
(2)化合物E2D分子的空间构型为,中心原子采用杂化。E与D还可形成三角锥结构的阴离子,该离子的化学式为,任意写出一种它的等电子体的化学式为。
(3)B与E能形成一种化合物BE4,其熔点:-25℃,沸点:l 36.4℃。则该化合物属于晶体,晶体内含有的作用力类型有。
(4)A、B、D三种元素形成的某晶体的晶胞结构如图,则晶体的化学式为。若最近的B与D的原子距离为a cm,该物质的摩尔质量为M g/mol,阿伏加德罗常数的数值为NA,则该晶体的密度为g/cm3。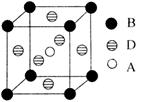
[化学一选修2:化学与技术](15分)随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐。最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,MnFe2O4的制备流程如下: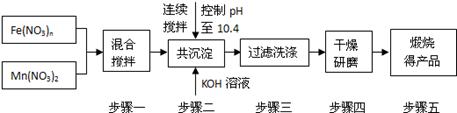
(1)原料Fe(NO3)n中n=,投入原料Fe(NO3)n和Mn(NO3)2的物质的量之比应为。
(2)步骤二中“连续搅拌”的目的是;步骤三中洗涤干净的标准是。
(3)利用MnFe2O4热化学循环制氢的反应可表示为:
MnFe2O4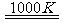 MnFe2O4-x+
MnFe2O4-x+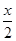 O2↑
O2↑
MnFe2O4+xH2O=MnFe2O4+xH2↑
请认真分析上述两个反应并回答下列问题:
①若MnFe2O4-x中x=0.8,则MnFe2O4-x中Fe2+占全部铁元素的百分比为。
②该热化学循环法制氢的优点有(答两点即可) 。
③该热化学循环法制氢尚有不足之处,进一步改进的研究方向是。
(13分)A、B、D是由常见的短周期非金属元素形成的单质,常温下A是淡黄色粉末,B、D是气体,F、G、H的焰色反应均为黄色,水溶液均显碱性,E有漂白性。它们之间的转化关系如图所示(部分产物及反应条件已略去),回答下列问题:
(1)A所含元素在周期表中的位置为,C的电子式为。
(2)A与H在加热条件下反应的化学方程式为。
(3)25℃时,pH均为10的H和G溶液,由水电离出的c(OH-)之比为。
(4)将A溶于沸腾的G溶液中可以制得化合物I,I在酸性溶液中不稳定,易生成等物质的量的A和E,I在酸性条件下生成A和E的离子方程式为。I是中强还原剂,在纺织、造纸工业中作为脱氯剂,向I溶液中通入氯气可发生反应,参加反应的I和氯气的物质的量比为1:4,该反应的离子方程式为。
(5)向含有0.4mol F、0.1 mol G的混合溶液中加入过量盐酸,完全反应后收集到a L气体C(标准状况),取反应后澄清溶液,加入过量FeCl3溶液,得到沉淀3.2g,则a=。