(1)中国古代四大发明之一——黑火药,它的爆炸反应为
2KNO3+3C+S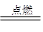 A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
①在生成物中,A的晶体类型为 ,含极性共价键的分子的中心原子轨道杂化类型为 。
②除S外,上列元素的电负性从大到小依次为 。
(2)①已知CN—与N2结构相似,推算HCN分子中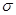 键与
键与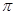 键数目之比为 。
键数目之比为 。
②原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为 ,Q2+的未成对电子数是 。
③在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:[CrCln(H2O)6-n]x++xR—H→Rx[CrCln(H2O)6-n]+xH+
交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成。 将含0.0015 mol [CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1 NaOH溶液25.00 ml,该配离子的化学式为 。
MgSO4·7H2O医药上用作泻剂。工业上用氯碱工业的一次盐泥为原料生产。已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分。主要工艺如下:
(1)用硫酸调整溶液pH为1~2,硫酸的作用是________________________________________。
(2)加次氯酸钠溶液至pH为5~6并加热煮沸约5~10 min,滤渣中主要含MnO2和另两种沉淀:__________________、____________(写化学式)。其中次氯酸钠溶液将MnSO4转化为MnO2的离子方程式为___________________________
(3)若除杂后过滤,发现滤液发黄,需采取的措施是________
(4)过滤后晶体常用丙酮代替蒸馏水洗涤的目的是________________________________________
(5)晶体中结晶水含量的测定:准确称取0.20 g MgSO4·7H2O样品,放入已干燥至恒重的瓷坩埚中,置于马沸炉中,在200 ℃脱水1 h。为准确确定脱水后的质量,还需要经过的操作有冷却(干燥器中)至室温→___________________________
(6)硫酸根离子质量分数的测定:准确称取自制的样品0.50 g,用200 mL水溶解,加入2 mol·L-1 HCl溶液5 mL,将溶液加热至沸腾,在不断搅拌下逐滴加入5~6 mL 0.5 mol/L BaCl2溶液,充分沉淀后,得沉淀0.466 g,则样品中w(SO42-)=________________。
(7)已知:Na2CO3·10H2O (s)=Na2CO3(s)+10H2O(g)ΔH1=+532.36 kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g)ΔH2=+473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式____________。
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
正极反应负极反应。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为
0.10mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤。
| 氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
| Fe3+ Fe2+ Cu2+ |
1.9 7.0 4.7 |
3.2 9.0 6.7 |
| 提供的药品:Cl2浓H2SO4 NaOH溶液 CuO Cu |
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式
劣质不锈钢腐蚀的实验现象
请仔细阅读以下转化关系: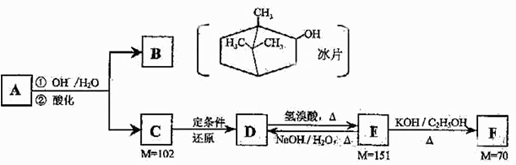
A是从蛇床子果实中提取的一种中草药有效成分,是由碳、氢、氧元素组成的酯类化合物;
B称作冰片,可用于医药和制香精,樟脑等;
C的核磁共振氢谱显示其分子中含有4种氢原子;
D中只含一个氧原子,与Na反应放出H2;
F为烃。
请回答:
(1)B的分子式为。
(2)B不能发生的反应是(填序号)。
a.氧化反应 b.聚合反应 c.消去反应 d.取代反应 e.与Br2加成反应.
(3)写出D→E、E→F的反应类型:D→E、E→F。
(4)F的分子式为。化合物H是F的同系物,相对分子质量为56,写出H所有可能的结构;。
(5)写出A、C的结构简式并用系统命名法给F命名:
A:_、C:、F的名称:。
(6)写出E→D的化学方程式。
已知X、Y、Z、M、Q、G、R、T,前四周期的8种元素(未按照原子序数排列),Z元素的某种氢化物可用作火箭的燃料;Q元素的单质为绿色植物光合作用的一种产物;根据化学对角线法则,G元素对角线的另一种元素T的单质可溶于R元素最高价氧化物所对应水溶液中并且目前易拉罐包含G元素最多;Y元素的价电子排布式为(n+1)Sn (n+1)P(n+3); X元素某种的盐溶液可以与M元素的单质发生反应,并能生成X元素的单质,且两者核电荷数相差3,且M元素的单质是地壳含量第二高的金属元素;R元素为第三周期的某种元素。
(1)写出X元素的价电子排布式,Z元素对应的最简单氢化物的空间构型。
(2)写出元素T的单质可溶于R元素最高价氧化物所对应水溶液对应的离子方程式:
。
(3)Q元素所对应的氢化物的沸点比同主族元素所对应氢化物沸点高的原因是:
。
(4)生活中,应将含Y、Q元素的某种粉末状物质密封、避光、干燥保存,且该粉末状物质经常在洗衣服时用到,请用化学方程式说明,该物质敞放在空气失效的原因:
。
(5)Z元素的某种氢化物,可用作火箭燃料,且该化合物中Z原子与氢原子的个数比为1:2,工业上用尿素和漂白液的主要有效成分,在R元素最高价氧化物所对应水溶液中并用高锰酸钾作为催化剂反应生成这种名为水合氨的化合物,生成的其它产物中某种离子,可以与CaCl2溶液反应生成某种白色沉淀,大理石中主要含这种成分。通过以上资料,写出该化学方程式:
。
(6)若取M元素的某种氧化物于试管中,加入稀盐酸调pH约为7,加入淀粉-KI溶液和Q元素的某种化合物,且该化合物的空间构型为异面折线形,反应完后溶液呈蓝色并有红褐色沉淀生成。当消耗2mol I-时,共转移3mol电子,该反应的离子方程式:
。
合成口服抗菌药琥乙红霉素片的原料G、某种广泛应用于电子领域的高分子化合物I的合成路线如下:
已知:① R—CH2—CH=CH2 R—CHCl—CH=CH2
R—CHCl—CH=CH2
②R—CH2—CH=CH2 R—CH2CH2CH2CHO
R—CH2CH2CH2CHO
(1)C的结构简式是,E中的官能团的名称是。
(2)写出A B的反应方程式,该反应类型是。
B的反应方程式,该反应类型是。
(3)H的分子式为C8H6O4,能与碳酸钠溶液反应放出气体,其一氯取代物只有一种,试写出E+H I的反应方程式。
I的反应方程式。
(4)关于G的说法中错误的是 (填序号)。
a.1 mol G最多可与2 mol NaHCO3反应
b.G可发生消去反应
c.1 mol G最多可与2 mol H2发生加成反应
d.1 mol G在一定条件下可与2 mol乙醇发生取代反应