某化学兴趣小组探究NH4Cl、CaCl2、NaCl三种物质溶于水过程中的热量变化.
【药品器材】
水、NH4Cl、CaCl2、NaCl;
烧杯、药匙、玻璃棒、量筒、温度计等.
【实验探究】
三种物质各取1药匙于烧杯分别溶于水,另还有一个烧杯只加水,用温度计测量液体温度,并记录有关数据如下:
| 实验 |
水的体积 |
所加物质 |
测量液体温度(℃) |
| 实验1 |
50mL |
NH4Cl |
15 |
| 实验2 |
50mL |
CaCl2 |
28 |
| 实验3 |
X |
NaCl |
21 |
| 实验4 |
50mL |
无 |
22 |
【数据分析】
(1)表中X为________mL.
(2)比较实验2与实验4,可获得的结论是________________.
(3)如果要生产一种“冰袋”用于冷敷,上述三种物质中最合适的是________.
【反思提升】
(4)经讨论该小组认为本实验操作中存在缺陷,它是________(填选项,可多选).
A.实验操作过程没有采取较为严格的保温措施
B.加入物质的质量可能不相等
C.加入物质的种类不一样
实验室产生的废液应该进行无害化处理,尽量实现绿色排放(使废液呈中性排放)。某实验小组在进行如右图所示的实验之后,将废液收集在一个洁净的废液缸中,进行绿色排放。请分别回答以下问题。
碳酸氢钠溶液呈碱性;氯化钙溶液呈中性写出碳酸钠溶液滴入到澄清石灰水中发生反应的化学方程式________。
若观察到废液缸里的废液澄清,用pH试纸测得废液的pH为2。废液显________性;废液中溶质为________。
若观察到废液缸里的废液呈白色浑浊状态,用pH试纸测得废液的pH为13,废液中可能有________(填字母序号)。
| A.氢氧化钠 | B.碳酸钠 |
| C.氢氧化钠、碳酸钠 | D.氢氧化钠、氢氧化钙 |
E.氢氧化钠、氢氧化钙、碳酸钠
如果将此种情况下废液缸里的废液实现绿色排放,加入的试剂依次是________。
小杰取一支试管加入少量的碳酸钠溶液,向其中滴加一定量的澄清石灰水,充分反应后过滤,得到澄清的滤液。小杰对该滤液的成分进行了如下实验探究,请补全实验报告:
| 实验步骤 |
实验现象 |
实验结论 |
| 取少量滤液于试管中,加入__________溶液 |
无气泡产生 |
滤液中不含有__________ |
| 另取滤液于试管中,向其中 __________ |
__________ |
滤液中含有Ca(OH)2 |
通常人们蒸馒头都是在发酵的面粉中加入适量的纯碱(Na2CO3)而小明同学发现妈妈今天蒸馒头并没有“发面”,而是在面粉中直接加入适量的小苏打(NaHCO3),也蒸出了蜂窝均匀,口感松软的馒头,于是提出问题:蜂窝是怎么产生的呢?
猜想假设:NaHCO3受热能分解产生二氧化碳气体。
实验设计:小明拟定选择右图装置进行实验。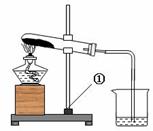
观察并记录实验现象:
| 实验操作 |
实验现象 |
实验结论 |
| (1)连接仪器,并 (2)将少量碳酸氢钠装入干燥的试管中,固定在铁架台上 (3)用酒精灯加热试管 |
试管内壁有无色液滴 |
|
| (4)将产生的气体通入盛有澄清石灰水的小烧杯中 |
有二氧化碳产生 |
|
| (5)加热至无气体产生时,停止加热 |
试管内剩余白色固体物质 |
实验完毕,小明非常得意,想完成上述反应的化学方程式,却发现了新的问题。即试管内的残留固体究竟是:NaOH 、Na2CO3、Na2O中的哪一种?
于是查阅资料:酒精灯加热温度约500~600 ℃;完全反应时试管内的剩余物为纯净物;Na2CO3加热到851℃熔化而不分解;NaOH加热到1390 ℃沸腾不分解;
2NaOH+CO2=Na2CO3+H2O;Na2O+H2O=2NaOH
根据资料和你所学的化学知识,你的猜想是。(填化学式)
验证你的猜想,填写下列实验方案:
| 实验步骤 |
实验现象 |
实验结论 |
某化学兴趣小组为测定Fe、Cu、Ag三种金属的活动性顺序,设计了几种实验方案。请你参与并完善下列方案中的试剂(每种方案只需列出所用试剂)。
方案一:Fe、Ag、;
方案二:Cu、、AgNO3溶液;
方案三:Fe、Cu、AgNO3溶液、。
小郑同学对烧煮食物的某种固体酒精产生了浓厚的兴趣,于是她进行了以下探究活动。请你一起参与她的探究过程吧!
【提出问题】固体酒精是固态的酒精吗?
【查阅资料一】酒精,学名乙醇,化学式为C2H6O,熔点为-114.1℃,沸点为78.5℃,易溶于水,能与水以任意比互溶。
【得出结论】小郑认为固体酒精不是固态的酒精,她作出该判断的理由是:。
【实验探究Ⅰ】
取少量固体酒精置于蒸发皿中,用火柴点燃,固体酒精完全燃烧后,蒸发皿中残余了少量白色固体。
【提出新问题】白色固体究竟是什么呢?
【查阅资料二】
由硬脂酸和氢氧化钠反应生成的硬脂酸钠作为凝固剂,酒精填充在硬脂酸钠骨架间隙中,即可得到固体酒精。固体酒精在较高的温度下燃烧可发生反应:(1)硬脂酸钠可完全转化为硬脂酸和氢氧化钠:(2)硬脂酸和酒精均可完全燃烧生成二氧化碳和水。
【实验探究Ⅱ】请你完成以下实验报告。
| 序号 |
实验步骤 |
实验现象 |
实验结论 |
| ① |
用铂丝蘸取该固体在酒精灯上灼烧。 |
火焰呈黄色 |
固体中含有Na+。 |
| ② |
将该固体置于足量蒸馏水中。 |
固体全部溶解。 |
固体可溶于水。 |
| ③ |
取少量②所得溶液,向其中滴加紫色石蕊试液,并振荡。 |
溶液变蓝。 |
溶液为碱性。 |
| ④ |
该固体为NaOH和Na2CO3的混合物。 |
实验结论:小郑认为该白色固体为NaOH和Na2CO3的混合物。
【联想与解释】小郑联想到老师用玻璃导管将纯净的氢气导出并点燃时,燃烧火焰为黄色,其原因可能是:。
【反思和评价】实验完毕后,小郑怀疑自己结论的可靠性,认为固体酒精燃烧后残留固体还可能含有NaHCO3。于是她又上网查找Na2CO3和NaHCO3的有关资料,发现它们性质有一个明显的差别:Na2CO3热稳定性好,NaHCO3受热容易分解成Na2CO3、H2O和CO2。于是她最终确定:在【实验探究Ⅱ】中获得的结论是正确的,白色固体不会含NaHCO3。那么你认为她的最终结论正确吗?
你的观点:她的最终结论(填“正确”或“错误”)。
你的理由:。