一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
2CO(g)+SO2(g) 2CO2(g)+S(l)△H
2CO2(g)+S(l)△H
(1)已知2CO(g)+O2(g)=2CO2(g)△H1=-566kJ/mol
S(l)+O2(g)=SO2(g)△H2=-296kJ/mol
则反应热△H= ___________kJ/mol;
(2)一定温度下,向2L恒容密闭容器中通入2molCO和1molSO2,在催化剂作用下发生反应生成CO2(g)和S(l)。
①若反应进行到25min时测得CO2的体积分数为0.5。则前25min的反应速率v(CO)=_____;
②若反应进行到40min时反应达到平衡状态,此时测得容器中气体的密度比反应前减少了12.8g/L,则CO的物质的量浓度c(CO)=____________;化学平衡常数K=________;
(3)若向2L恒容密闭容器中通入2molCO和1molSO2,反应在不同条件下进行反应:CO2(g)和S(l)。反应体系总压强随时间的变化如图所示。
①图中三组实验从反应开始至达到平衡时的反应速率v(CO)由大到小的次序为_________(填实验序号);与实验a相比,c组改变的实验条件可能是__________;
②用P0表示开始时总压强,P表示平衡时总压强,用α表示CO的平衡转化率,则α的表达式为____。
[化学——选修5:有机化学基础]
已知有机物M中只含有C、H、O三种元素,其相对分子质量为88。与M有关的反应如下: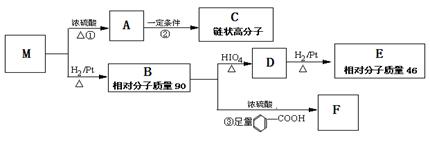
已知: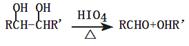
请按要求回答下列问题:
(1)M的分子式为_________,其分子中除碳氧双键外的官能团的名称为_______________。
(2)写出①、③的反应类型:①_______________________,③_______________________。
(3)E的名称___________,检验D中官能团的试剂是___________。
(4)写出反应②的化学方程式:____________________________________________;
(5)X是M的同分异构体,且X属于酯类,其结构简式有__________种,请写出只含一个
甲基的结构简式:__________________。
[化学——选修3:物质结构与性质]
已知元素A、B、C、D、E、F均属前四周期且原子序数依次增大, 其中A含有3个能级,且每个能级所含的电子数相同,C的基态原子2p轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F除最外层原子轨道处于半充满状态,其余能层均充满电子,请回答下列问题:
(1)元素A、B、C的第一电离能由小到大的是_______(用元素符号表示)。
(2)F原子的外围电子排布式为_______,F的晶体中原子的堆积方式是下图中的_______(填写“甲”、“乙”或“丙”)。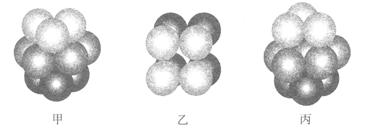
(3)B与C形成的四原子阴离子的立体构型为,其中B原子的杂化类型是。
(4)任写一种与AB-离子互为等电子体的离子。
(5)F(OH)2难溶于水,易溶于氨水,写出其溶于氨水的离子方程式。
(6)D和E形成的化合物的晶胞结构如图,其化学式为,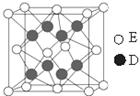
已知晶体的密度为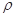 g·cm-3,阿伏加德罗常数为NA,
g·cm-3,阿伏加德罗常数为NA,
则晶胞边长a=cm。(用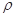 、NA的计算式表示)
、NA的计算式表示)
(7)A、B、C三种元素和氢元素形成的氰酸有两种结构,一种分子
内含有叁键,称为氰酸,另一种分子内不含叁键,称为异氰酸,
且两种结构中所有原子最外层均已达到稳定结构,分子中也不含环状结构。请分别写
出氰酸和异氰酸的结构式:_______________、______________。
【化学——选修2:化学与技术】
无水AlCl3易升华,可用作有机合成的催化剂等。工业上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。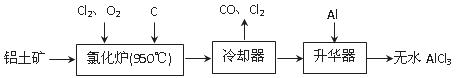
(1)氯化炉中Al2O3、C12和C反应的化学方程式为。
(2)用Na2SO3溶液可除去冷却器排出尾气中的Cl2,此反应的离子方程式为。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是。
(4)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
①写出除杂过程中涉及的离子方程式、。
②AlCl3产品的纯度为。
(5)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3·6H2O脱水制备无水AlCl3,实现这一步的方法是。
(6)生铁中含有一种铁碳化合物(Fe3C),工业上要测定碳元素的质量分数,第一步是在足量的空气中煅烧,生成有磁性的固体,该反应的化学方程式是。
Ⅰ.通常状况下,X、Y和Z是三种气态单质。X的组成元素是第三周期原子半径最小的元素(稀有气体元素除外);Y和Z均由元素R组成,反应Y+2I-+2H+====I2+Z+H2O常作为Y的鉴定反应。W是短周期元素,最外层电子数是最内层电子数的三倍,吸引电子对的能力比X单质的组成元素要弱。
(1) Z的化学式__________________
(2)将Y和二氧化硫分别通入品红溶液,都能使品红褪色。简述用褪色的溶液区别Y和二氧化硫的实验方法:________________________________________________________。
(3)举出实例说明X的氧化性比W单质氧化性强(仅用一个化学方程式表示):_____________。
Ⅱ.如图是0.1 mol·L-1四种电解质溶液的pH随温度变化的图像。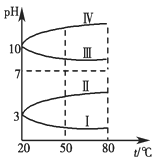
(1)其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是________(填写序号),
(2)20 ℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=________。(计算精确值)
(3)室温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
试分析图中a、b、c、d四个点,水的电离程度最大是________点;在b点,溶液中各离子浓度由大到小的排列顺序是______________________
某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图所示),大大地提高了资源利用率,减少了环境污染。
请填写下列空白:
(1)写出钛铁矿经氯化得到四氯化钛的化学方程式:。
(2)由CO和H2合成甲醇是放热的,方程式是:CO(g)+2H2(g)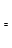 CH3OH(g)。
CH3OH(g)。
①已知该反应在300℃时的化学平衡常数为0.27,该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将(填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
②下图表示合成甲醇反应达到平衡后,每次只改变温度、压强、催化剂中的某一条件,反应速率υ与时间t的关系。其中表示平衡混合物中的甲醇的含量最高的一段时间是。图中t3时改变的条件可能是。
(3)某同学设计了一个甲醇燃料电池,并用该电池电解200mL—定浓度NaCl与CuSO4混合溶液,其装置如图: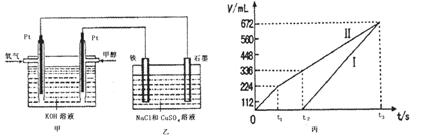
①写出甲中通入甲醇这一极的电极反应式。
②理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式,原混合溶液中NaCl的物质的量浓度为mol/L。(假设溶液体积不变)