二氧化碳是引起“温室效应”的主要物质,节能减排、高效利用能源能够减少二氧化碳的排放。
(1)在一定温度下的2L固定容积的密闭容器中,通入2 mol CO2和3mol H2,发生的反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-a kJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H=-a kJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
①能说明该反应已达平衡状态的是______ __。
A.CO2的体积分数在混合气体中保持不变
B.混合气体的密度不随时间的变化而变化。
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O。 D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变。
D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变。
②下列措施中能使 增大的是________(选填编号)。
增大的是________(选填编号)。
A.升高温度
B.恒温恒容下充入He(g) C.将H2O(g)从体系中分离
C.将H2O(g)从体系中分离
D.恒温恒容再充入2 mol CO2和3 mol H2
③计算该温度下此反应的平衡常数K=__________。若改变条件(填选项),可使K=1。
A.增大压强
B.增大反应物浓度
C.降低温度
D.升高温度
E.加入催化剂
(2)某甲醇燃料电池原理如下图1所示。
①M区发生反应的电极反应式为_______________________________。
②用上述电池做电源,用上图2装置电解饱和食盐水(电极均为惰性电极),则该电解反应的总反应的离子方程式为________________________。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
(12分)牛奶放置时间长了会变酸,这是因为牛奶中含有不少乳糖,在微生物的作用下乳糖分解而变成乳酸。乳酸最初就是从酸牛奶中得到并由此而得名的。乳酸的结构简式为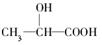 。完成下列问题:
。完成下列问题:
(1)写出乳酸分子中官能团的名称:________ ______。
(2)一定条件下乳酸能发生的反应类型有____ __ __(填序号)。
| A.水解反应 | B.取代反应 | C.加成反应 | D.中和反应 E.氧化反应 F.酯化反应 |
(3)写出乳酸与碳酸钠溶液反应的化学方程式:____________ _。
(4)乳酸在浓硫酸作用下,两分子相互反应生成链状结构的物质,写出此生成物的结构简式:____
以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:

氯化铵和硫酸钠的溶解度随温度变化如上图所示。回答下列问题:
(1)写出制备 NH4Cl的化学方程式:。
(2)实验室进行蒸发浓缩用到的主要仪器有、带铁圈的铁架台、玻璃棒、酒精灯等。
(3)实验过程中趁热过滤的目的是。冷却结晶后的过滤采用抽滤,其装置如图1所示,请指出该装置中的错误之处;

图1图2
(4)趁热过滤后,滤液冷却结晶。一般情况下,下列哪些因素有利于得到较大的晶体。
| A.缓慢冷却溶液 | B.溶液浓度较高 |
| C.溶质溶解度较小 | D.缓慢蒸发溶剂 |
(5)为定粗产品的含氮量,称取11.2gNH4Cl粗产品,用图2装置进行实验,充分反应后,测得B装置增重3.4g。则该粗产品中含氮的质量分数为。
【化学-有机化学基础】
北京市疾病预防控制中心的调查结果显示,在北京市场上有九成受检香水和三成护发类化妆品被查出致癌物”邻苯二甲酸酯”(PAEs),值得注意的是,在儿童护肤类化妆品中亦有两件样品分别被检出邻苯二甲酸二乙酯(DEP)和邻苯二甲酸二(2-乙基己基)(DEHP)。
(1)邻苯二甲酸二乙酯(DEP)的结构简式为,其核磁共振氢谱共有组吸收峰,峰面积之比为。
(2)以下是某课题组设计的合成邻苯二甲酸二乙酯(DEP)的路线: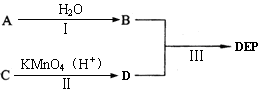
已知:

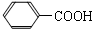
①C的结构简式为,其一溴代物有种。
②反应Ⅰ属于反应,反应Ⅲ属于反应。
③D和乙二醇在一定条件下可以发生反应生成一种高分子化合物,写出化学方程式。
纳米TiO2具有独特的光催化性、优异的颜色效应以及紫外线屏蔽等功能,在光催化剂、化妆品、抗紫外线吸收剂、功能陶瓷、气敏传感器件等方面具有广阔的应用前景。工业上用钛铁精矿(FeTiO3)提炼TiO2的工艺流程如下: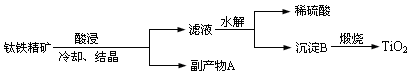
(1)写出硫酸酸浸溶解钛铁精矿的离子方程式,酸浸时为了提高浸出率,可以采取的措施为。
(2)钛铁精矿后冷却、结晶得到的副产物A为,结晶析出A时,为保持较高的酸度不能加水,其原因可能为 。
(3)滤液水解时往往需加大量水稀释同时加热,其目的是。
(4)上述工艺流程中体现绿色化学理念的是。
(5)工业上将TiO2和炭粉混合加热氯化生成的TiCl4,然后在高温下用金属镁还原TiCl4得到金属钛,写出TiO2制备Ti的化学方程式:。
浸出-萃取-电积法已成为铜湿法冶金的主要工艺过程。以黄铜铜为原料,采用电积法生产阴极铜生产线,主要生产工艺为:
黄铜铜→硫酸浸出→过滤→萃取→反萃→电积→阴极铜。
(1)浸出是用浸矿剂将铜矿石中的铜进入溶液中。据报道,有一种叫Thibacillus Ferroxidans的细菌在氧气存在下,酸性溶液中,将黄铜矿氧化成硫酸盐,写出用硫酸浸出黄铜矿发生反应的离子方程式:。
(2)萃取是利用特效铜萃取剂在含铜、铁及其碱性金属离子的低浓度含杂浸出液中有选择性地使铜离子萃入有机相,将铜离子与其它金属离子有效地分离,并通过反萃取使低浓度铜离子的原液富集成适宜电积要求的硫酸铜溶液。萃取过程的化学平衡为:2RH+Cu2+ R2Cu+2H+。则萃取和反萃取进行的程度受和的影响。
R2Cu+2H+。则萃取和反萃取进行的程度受和的影响。
(3)电积是将萃取富集后的铜溶液电解沉积出阴极铜。右图为用惰性阳极电积阴极铜的装置图:
①在图示方框中标出电源的正负极。
②写出电积阴极铜的总反应。
(4)金属铜长期露置于空气中容易生锈,铜锈的主要成分为,请利用电化学原理画出防止铜腐蚀的装置图。