某小组为研究原电池原理,设计如图装置,下列叙述正确的是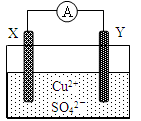
| A.若X为Fe,Y为Cu,铁为正极 |
| B.若X为Fe,Y为Cu,电子由铜片流向铁片 |
| C.若X为Fe,Y为C,碳棒上有红色固体析出 |
| D.若X为Cu,Y为Zn,锌片发生还原反应 |
在化学反应中,反应前与反应后相比较,肯定不变的是()
①元素的种类②原子的种类
③分子的数目④原子的数目
⑤反应前物质的总质量和反应后物质的总质量
⑥如果水溶液中反应,则反应前与反应后阳离子所带的正电荷总数
⑦反应前反应物的总能量与反应后生成物的总能量
| A.①②③④⑦ | B.①②⑤⑥⑦ |
| C.①②④⑤ | D.②③⑤⑥⑦ |
已知盐酸或硫酸和烧碱的稀溶液反应的热化学方程式为H+(aq)+OH-(aq)=H2O(l)△H=-Q1 kJ/mol。又知,HF(aq)+KOH(aq)=KF(aq)+H20(l) △H=-Q2 kJ/mol
则Q1与Q2的关系正确的是()
| A.Q1=Q2 | B.Q1﹤Q2 | C.Q1﹥Q2 | D.无法比较 |
已知H—H键的键能为436kJ/mol,N—H键的键能为391kJ/mol,根据热化学方程式:N2+3H2=2NH3△H ="-" 92.4 kJ/mol可得N≡N键的键能是()
| A.431 kJ/mol | B.945.6 KJ/mol |
| C.649 kJ/mol | D.869 kJ/mol |
某K2CO3样品中含有KNO3和Ba(NO3)2两种杂质中的一种或两种,现将6.9 g样品溶于足量水中,得到澄清溶液,若再加入过量的CaCl2溶液,得到4.5g沉淀,对样品所含杂质的正确判断是
| A.肯定有KNO3,没有Ba(NO3)2 | B.肯定有Ba(NO3)2,可能有KNO3 |
| C.KNO3和Ba(NO3)2都有 | D.只有Ba(NO3)2 |
将下列金属投入到1L 2mol/L的盐酸溶液中,产生氢气最多的是:
| A.56gNa | B.56g铁 | C.1molAl | D.1molMg |