已知某反应为:
(1)1molM完全燃烧需要 molO2.
(2)有机物N不可发生的反应为 :
A.氧化反应
B.取代反应
C.消去反应
D.还原反应
E.加成反应
(3)M有多种同分异构体,其中能使FeCl3溶液显紫色、苯环上只有两个取代基、无环物质的同分异构体有 种.
(4)物质N与H2反应生成的P(结构简式为 )发生缩聚反应产物的结构简式为 ;P物质的钠盐在适当条件下氧化为芳香醛Q,则Q与银氨溶液发生反应的化学方程式为 .
)发生缩聚反应产物的结构简式为 ;P物质的钠盐在适当条件下氧化为芳香醛Q,则Q与银氨溶液发生反应的化学方程式为 .
(5)有机物Ⅰ、Ⅱ、Ⅲ的转化关系为:
有机物Ⅱ的结构简式为 ;A、B可以发生类似①的反应生成有机物Ⅰ,则该反应的化学方程式为 .
下列方法中可以证明2HI(g) H2(g)+I2(g)已达平衡状态的是( )
①单位时间内生成n mol H2的同时生成n mol HI
②一个H-H键断裂的同时有两个H-I键断裂
③百分组成HI%=I2%
④反应速率υ(H2)=υ(I2)=0.5υ(HI)时
⑤ [HI]=[H2]=[I2]=2:1:1
⑥温度和体积一定时,某一生成物浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧条件一定,混合气体的平均相对分子质量不再变化
⑨温度和体积一定时混合气体的颜色不再变化
⑩温度和压强一定时混合气体密度不再变化
在一定温度下,反应2NO2  N2O4达平衡的标志是 。
N2O4达平衡的标志是 。
| A.混合气颜色不随时间的变化 |
| B.数值上v(NO2生成)=2v(N2O4消耗) |
| C.单位时间内反应物减少的分子数等于生成物增加的分子数 |
| D.压强不随时间的变化而变化 |
E.混合气的平均分子量不变
在一容积固定的反应容器中,有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应。各物质的起始加入量如下: A、 B和C均为4.0mol, D为 6.5mol, F为2.0mol,设E为xmol,x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器的正中间位置。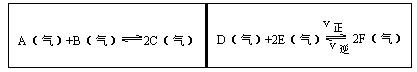
①若x=4.5,则右侧反应在起始时向______方向进行,欲使起始反应维持向该方向进行,则x的取值范围为____ 。
②若x分别为4.5和5.0,则在这两种情况下,当反应达平衡时,A的物质的量是否相等?______,其理由是______。
用金属钠制取Na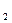 O,通常用NaNO
O,通常用NaNO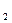 和Na反应:2NaNO
和Na反应:2NaNO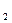 +6Na
+6Na 4Na
4Na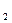 O+N
O+N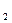 ↑。试解释为什么采用这种方法制取而不用钠在氧气中燃烧的方法。
↑。试解释为什么采用这种方法制取而不用钠在氧气中燃烧的方法。
下图表示A~E五种物质的相互转化关系,其中A为淡黄色固体,B为单质。
(1)试推断A、B、C、D、E的化学式:
A.________,B. ________,C. ________,
D. ________,E. ________。
(2)写出标号①②③⑧的化学反应方程式:
①________________________________,
②________________________________,
③________________________________,
⑧________________________________。