(14分)雾霾由多种污染物形成,其中包含颗粒物(包括PM2.5在内)、氮氧化物(NOx)、CO、SO2等。化学在解决雾霾污染中有着重要的作用。
(1)已知:2SO2(g)+O2(g)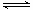 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)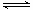 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)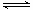 SO3(g)+NO(g)ΔH= kJ·mol-1。
SO3(g)+NO(g)ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于恒温恒容的密闭容器中发生上述反应,下列能说明反应达到平衡状态的有 。
a.体系密度保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1:5,则平衡常数K= 。
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)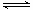 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。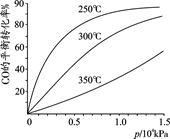
(3)下图是一种用NH3脱除烟气中NO的原理。
①该脱硝原理中,NO最终转化为H2O和 (填化学式)。
②当消耗1 mol NH3和0.5 molO2时,除去的NO在标准状况下的体积为 L。
(4)NO直接催化分解(生成N2和O2)也是一种脱硝途径。在不同条件下,NO的分解产物不同。在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图所示,写出NO分解的化学方程式 。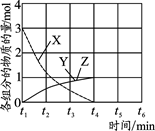
肼(N2H4)是火箭发射常用的燃料。一种以肼(N2H4)为燃料的电池装置如图所示。该燃料电池的电极材料采用多孔导电材料,以提高电极反应物在电极表面的吸附量,并使它们与电解质溶液充分接触,以空气中的氧气作为氧化剂,KOH溶液作为电解质。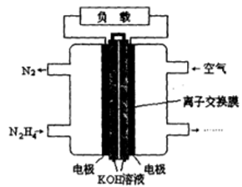
(1)负极上发生的电极反应为_________________;
(2)电池工作时产生的电流从_______电极经过负载后流向________电极(填“左侧”或“右侧”)。
(3)放电一段时间后,右侧溶液的pH (填“变大”或“变小”)
(12分)
Ⅰ.含氯消毒剂可防甲型H1N1流感。二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与Na2SO3反应制得。
(1)请写出反应的离子方程式_________________________________________________。
Ⅱ.某无色溶液只含有下列8种离子中的某几种:Na+、H+、Mg2+、Ag+、Cl-、OH-、HCO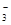 、NO
、NO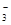 。已知该溶液可与Al2O3反应,则:
。已知该溶液可与Al2O3反应,则:
(2)该溶液与Al2O3反应后有Al3+生成,则原溶液中一定含有_____,一定不会含有大量的________。
(3)该溶液与Al2O3反应后有AlO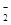 生成,则原溶液中一定含有_______,可能含有大量的________。
生成,则原溶液中一定含有_______,可能含有大量的________。
(4)写出该溶液与Al2O3反应生成AlO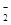 的离子方程式___________________________。
的离子方程式___________________________。
(6分)氯化铜晶体(CuCl2·2H2O)含有FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下列操作步骤进行提纯:
①先加入氧化剂X,再加入物质Y,过滤得沉淀Z;
②将滤液蒸发结晶得纯CuCl2·2H2O晶体。
已知:三种离子从溶液中完全呈氢氧化物沉淀所需pH值:Fe3+:3.7,Cu2+:6.4,Fe2+:6.4试回答下列问题:
(1)加入氧化剂X的原因是______。
(2)下列物质都可以作为氧化剂,其中最适宜于本实验的是()
| A.H2O2 | B.KMnO4 | C.NaClO | D.K2CrO7 |
(3)物质Y是______,沉淀Z是______.
(4)为分离出沉淀Z,采取的实验操作所用仪器有______。
(5)操作②所用的仪器有______。
在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为650mg / L。现用氯氧化法处理,发生如下反应(其中N均为-3价):KCN+2KOH+Cl2 → KOCN+2KCl+H2O被氧化的元素是。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平虾类方程式,并标出电子转移数目:
KOSN+ KOH+Cl2→CO2+ N2+KCl+H2O
(3)若处理尚书废水20L,使KCN完成转化为无毒物质,至少需要液氯g。
(12分)亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。以下是制取亚氯酸钠的工艺流程: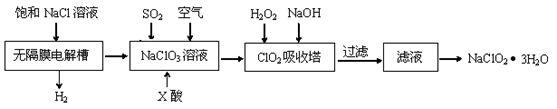
已知:①ClO2气体只能保持在浓度较低状态下以防止爆炸性分解,且需现合成现用。
②ClO2气体在中性和碱性溶液中不能稳定存在。
(1)在无隔膜电解槽中持续电解一段时间后,生成氢气和NaClO3,请写出阳极的电极反应方程式。
(2)反应生成ClO2气体需要X酸酸化,X酸可以为。
| A.盐酸 | B.稀硫酸 | C.硝酸 | D.H2C2O4溶液 |
(3)吸收塔内的温度不能过高的原因为。
(4)ClO2被S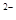 还原为ClO
还原为ClO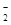 、Cl
、Cl 转化率与pH关系如图。
转化率与pH关系如图。
写出pH≤2时ClO2与S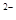 反应的离子方程式:。
反应的离子方程式:。
(5)ClO2对污水中Fe2+、Mn2+、S2-和CN 等有明显的去除效果。某工厂污水中含CN
等有明显的去除效果。某工厂污水中含CN amg/L,现用ClO2将CN
amg/L,现用ClO2将CN 氧化,生成了两种无毒无害的气体,其离子反应方程式为_______________________;处理100 m3这种污水,至少需要ClO2 _____________ mol。
氧化,生成了两种无毒无害的气体,其离子反应方程式为_______________________;处理100 m3这种污水,至少需要ClO2 _____________ mol。