X、Y、Z、W是原子序数依次增大的四种短周期元素,X的最高价氧化物对应的水化物的化学式为H2XO3,Y的最外层电子数是电子层数的3倍,Z是地壳中含量最高的金属元素,W的一种核素的质量数为28,中子数为14。下列说法正确的是
| A.原子半径由大到小的顺序是Z>W>Y>X |
| B.元素的非金属性W>Y>X |
| C.Z2Y3、WX分别是离子化合物、共价化合物 |
| D.X、Z、W的最高价氧化物都是酸性氧化物 |
一定条件下,对于可逆反应X(g)+3Y(g)  2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1mol·L-1、0.3 mol·L-1、0.08mol·L-1,则下列判断正确的是
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1mol·L-1、0.3 mol·L-1、0.08mol·L-1,则下列判断正确的是
| A.c1:c2="1:3" | B.平衡时,Y和Z的生成速率之比为2:3 |
| C.X、Y的转化率不相等 | D.c1的取值范围为0.04<c1<0.14 mol·L-1 |
某溶液中发生反应:A=2B+C,A的反应速率v(A)与时间t的图象如图所示。若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是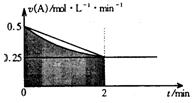
A.图中阴影部分的面积表示0~2min内A的物质的量浓度的减小值
B.反应开始的前2min,A的平均反应速率小于0.375mol·L-1·min-1
C.至2min时,A的物质的量减小值介于0.5mol至1mol之间
D.至2min时,c(B)介于1mol·L-1至1.5mol·L-1之间
下列实验操作中正确的是
| A.用托盘天平称取3.25gNaCl |
| B.测定未知NaOH溶液浓度时,酸式滴定管需用标准酸液润洗2—3次 |
| C.用碱式滴定管量取12.20mL高锰酸钾 |
| D.先将pH试纸用蒸馏水润湿后,再测定溶液的pH |
在容积一定的密闭容器中,反应2A B(g)+C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是
B(g)+C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是
| A.正反应是吸热反应,且A不是气态 |
| B.正反应是放热反应,且A是气态 |
| C.其他条件不变,加入少量A,该平衡向正反应方向移动 |
| D.改变压强对该平衡的移动无影响 |
T℃时,将气体X与气体Y置于一密闭容器中,反应生成气体Z,反应过程中各物质的浓度变化如图(I)所示。保持其他条件不变,在T1、T2两种温度下,Y的体积分数变化如图(Ⅱ)所示。下列结论正确的是
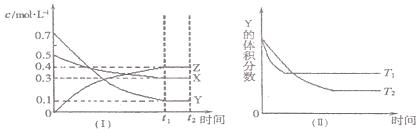

| A.t2时,保持其它条件和物质状态不变,增加压强,化学平衡向逆反应方向移动 |
| B.T℃时,若密闭容器中各物质起始浓度为:0.4 mol·L-1X、0.4 mol·L-1Y、0.2 mol·L-1Z。保持其他条件不变,达到平衡时z的浓度为0.4 mol·L-1 |
| C.图(Ⅱ)中T1>T2,正反应是吸热反应 |
D.其他条件不变,升高温度,正、逆反应速率均增大,且X的转化率增大 |