【化学——物质结构与性质】氢、碳、氮都是重要的非金属元素,它们单质及其化合物在科学研究和工业生产中有重要的应用。
(1)下列微粒基态的电子排布中未成对电子数最多的是_______(填序号)
a.Fe
b.Mn
c.Cu
d.Cr
e.C
(2)含氮配合物W的结构如图所示(配位键未标出方向),请在结构图中用“→”标出W中所存在的所有配位键的方向。
(3)C、H元素形成的某有机化合物分子中共有16个电子,该分子中 键与
键与 键的个数比为_______;该有机化合物在一定条件下形成的聚合物中C原子采取_______杂化。
键的个数比为_______;该有机化合物在一定条件下形成的聚合物中C原子采取_______杂化。
(4)N和Cu元素形成的化合物的晶胞结构如图所示,则该化合物的化学式为_______。该化合物的相对分子质量为M, 为阿伏加德罗常数。若该晶胞的边长为a pm,则该晶体的密度是_______g.pm
为阿伏加德罗常数。若该晶胞的边长为a pm,则该晶体的密度是_______g.pm 。
。
全球气候变暖已经成为全世界人类面临的重大问题,温家宝总理在“哥本哈根会议”上承诺到2020年中国减排温室气体40%。
⑴地球上的能源主要源于太阳,绿色植物的光合作用可以大量吸收CO2以减缓温室效应,主要过程可以描述分为下列三步(用“C5”表示C5H10O4,用“C3”表示C3H6O3):
Ⅰ、H2O(l)=2H+(aq)+1/2O2(g)+2e-△H=+284kJ/mol
Ⅱ、CO2(g)+C5(s)+2H+(aq)=2C3+(s)△H=+396kJ/mol
Ⅲ、12C3+(s)+12e-=C6H12O6(葡萄糖、s)+6C5(s)+3O2(g)△H=-1200kJ/mol
写出绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式。
⑵有效地开发利用CO2可以降低大气中CO2的含量,目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的恒容密闭容器中,充入1mol CO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)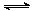 CH3OH(g)+H2O(g) △H=-49.0kJ/mol 。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H=-49.0kJ/mol 。测得CO2和CH3OH(g)的浓度随时间变化如图所示。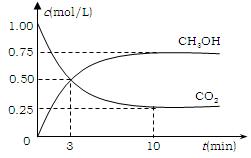
①从反应开始到平衡,氢气的平均反应速率
v(H2)=___________mol/(L·min);
②CO2的转化率=;
③该反应的平衡常数为(保留小数点后2位);
④ 下列措施中能使平衡体系中
下列措施中能使平衡体系中
n(CH3OH)/n(CO2)增大的是___________。
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离出去 | D.再充入1molCO2和3molH2 |
醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠是其常见的盐。
(已知:25℃,醋酸的电离平衡常数Ka(CH3COOH)=1×10-5)。请回答:
⑴写出醋酸钠在水中发生水解反应的离子方程式: ;
;
⑵在CH3COONa溶液中离子浓度由大到小的顺序为
(用“c(Bn+)”表示相应离子浓度);
⑶ 25℃时,醋酸的电离平衡常数表达式Ka=。0.10mol/L的醋酸溶液的pH等于(提示:醋酸的电离常数很小,平衡时的c(CH3COOH)可近似视为仍等于0.10mol/L;);
⑷物质的量浓度均为0.1mol /L的CH3COONa和CH3COOH溶液
/L的CH3COONa和CH3COOH溶液 等体积混合后溶液的PH<7(注:混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是;
等体积混合后溶液的PH<7(注:混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是;
| A.2c(Na+) =c(CH3COO-)+c(CH3COOH) |
| B.c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| C.c(CH3COO-)+c(CH3COOH)=0.1mol/L |
| D.c(Na+)> c(CH3COO-)> c(H+)> c(OH-) |
某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64)。

 按照实验步骤依次回答下列问题:
按照实验步骤依次回答下列问题:
(1)写出装置中锌电极上的电极反应式:;
(2)若装置中铜电极的质量增加0.64g,则导线中转移的电子数目为;
(用“NA”表示)
(3)装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的
K+、Cl-的移动方向表述正确的是。
A. 盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B. 盐桥中的K+向右侧烧杯移动、Cl-向左侧 烧杯移动
烧杯移动
C. 盐桥中的K+、Cl-都向右侧烧杯移动
D.盐桥中的K+、Cl-几乎都不移动
(4)若ZnSO4溶液中含有杂质Cu2+,会加速Zn电极的腐蚀、还可能导致电流在较短时间内衰减。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
A. NaOH B. Zn C. FeD. H2SO4
海水是人类宝贵的自然资源,从海水中可以提取多种化工原料,下图是某工厂对海水资源综合利用的示意图: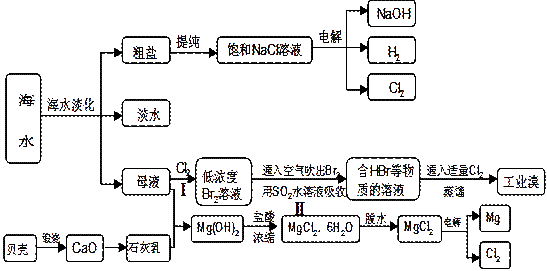
(1)请列举海水淡化的两种方法、。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br—,其目的是:。
步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式
(3)在制取无水氯化镁时需要在干躁的HCl气流中加热MgCl2•6H2O,其原因用化学方程式表示为
(4)上述工艺中可以得到金属M g,请写出工业上冶炼金属铝的化学方程式
g,请写出工业上冶炼金属铝的化学方程式
。
下表是五种银盐的溶度积常数(25℃):
| 化学式 |
AgCl |
Ag2SO4 |
Ag2S |
AgBr |
AgI |
| 溶度积 |
1.8×10-10 |
1.4×10- |
6.3×10-50 |
5.4×10-13 |
8.3×10-17 |
下列说法不正确的是:
| A.五种物质在常温下溶解度最大的是Ag2SO4 |
| B.将氯化银溶解于水后,向其中加入Na2S,则可以生成黑色沉淀Ag2S |
| C.氯化银、溴化银和碘化银三种物质在常温下的溶解度随着氯、溴、碘的顺序增大 |
| D.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动 |