某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路(已知发生的反应为:2FeCl3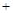 Cu → 2FeCl2
Cu → 2FeCl2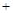 CuCl2)。课外活动小组为确认生产后的废液的组成,进行如下实验:(1)取10mL废液加入足量的AgNO3溶液,生成沉淀 8.61g。(2)另取10mL废液放入铜片充分反应,铜片质量减少了0.256g。下列关于原废液及其形成的判断正确的是
CuCl2)。课外活动小组为确认生产后的废液的组成,进行如下实验:(1)取10mL废液加入足量的AgNO3溶液,生成沉淀 8.61g。(2)另取10mL废液放入铜片充分反应,铜片质量减少了0.256g。下列关于原废液及其形成的判断正确的是
A.c(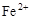 )︰c( )︰c(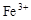 ) )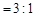 |
B.c(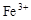 )︰c( )︰c(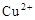 ) )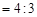 |
C.c(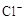 ) )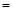 6mol/L,c( 6mol/L,c(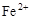 ) )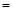 0.6mol/L 0.6mol/L |
| D.该绝缘板腐蚀后质量减少0.384g |
某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:
下列说法不正确的是()
| A.溶解烧渣选用足量硫酸,试剂X选用铁粉 |
| B.固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2 |
| C.从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解 |
| D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O |
向1LFeBr2溶液中,通入1.12L(标准状况下)的Cl2,测得溶液中c(Br一)=3c(Cl一),反应过程中溶液的体积变化忽略不计,则下列说法中正确的是()
| A.原溶液的浓度为0.1mol/L | B.反应后溶液中c(Fe3+)=0.1mol/L |
| C.反应后溶液中c(Fe3+)=c(Fe2+) | D.原溶液中c(Br一)=0.4mol/L |
下列物质见光不会分解的是()
| A.HClO | B.NH4Cl | C.HNO3 | D.AgNO3 |
0.1mol下列气体分别与1L0.lmol·L-1的NaOH溶液反应,形成的溶液pH最小的是( )
| A.NO2 | B.SO2 | C.SO3 | D.CO2 |
用右图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是()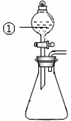
| 选项 |
①中物质 |
②中物质 |
预测②中的现象 |
| A. |
稀盐酸 |
碳酸钠与氢氧化钠的混合溶液 |
立即产生气泡 |
| B. |
浓硝酸 |
用砂纸打磨过的铝条 |
产生红棕色气体 |
| C. |
氯化铝溶液 |
浓氢氧化钠溶液 |
产生大量白色沉淀 |
| D. |
草酸溶液 |
高锰酸钾酸性溶液 |
溶液逐渐褪色 |