(本题共12分)元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
23、第三周期元素的原子所形成的简单离子中:还原性最弱的阴离子是 ;氧化性最强的阳离子是 。
24、下列事实可以作为S和Cl非金属性强弱的判断依据的是 (选填序号)
a.Cl的最高正价比S高 b.可用浓H2SO4制HCl
c.HCl的酸性比H2S强 d.Cl2与H2S反应生成S
25、硅元素最外层有 种能量不同的电子;SiCl4的空间构型和CH4相同,写出SiCl4的电子式: 。
26、PH3和NH3的某些化学性质相似。下列对晶体PH4I性质的推测,错误的是 (选填序号)
a.PH4I是一种共价化合物 b.PH4I能与烧碱溶液反应
c.PH4I加热后会发生升华 d.PH4I溶液能与溴水反应
27、二氯化二硫(S2C12)可用作橡胶工业的硫化剂,它的分子结构与H2O2相似。下列有关说法不正确的是 (选填序号)
a.S 2C12分子中有4对共用电子对
b.S2C12分子中没有非极性键
c.S2C12分子中,S为+1价,Cl为-1价
d.S2C12分子中各原子均为8电子稳定结构
28、已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO3-+H2O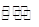 H2SO3+OH- ①
H2SO3+OH- ①
HSO3-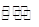 H++SO32- ②
H++SO32- ②
向0.1mol/L的NaHSO3溶液中加入少量氢氧化钠固体,则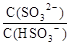 (填“增
(填“增
大”“减小”或“不变”,后同),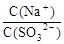 。
。
共聚法可改进有机高分子化合物的性质,高分子聚合物P的合成路线如下:
(1)B的名称为________________, E中所含官能团的名称为
(2)I由F经①~③合成,F可以使溴水褪色。
a.①的化学方程式是
b.②的反应试剂是
c.③的反应类型是
(3)下列说法正确的是
a.C可与水任意比例混合
b.A与1,3-丁二烯互为同系物
c.由I生成M时,1mol最多消耗3molNaOH
d.N不存在顺反异构体
写出E与N按照物质的量之比为1:1发生共聚生成P的化学反应方程式 :。
高聚物P的亲水性比由E形成的聚合物__________(填“强、弱”).
D的同系物K比D分子少一个碳原子,K 有多种同分异构体,符合下列条件的K的同分异构体有 种,写出其中核磁共振氢谱为1:2:2:2:3的一种同分异构体的结构简式。
a.苯环上有两种等效氢
b.能与氢氧化钠溶液反应
c.一定条件下1mol该有机物与足量金属钠充分反应,生成1molH2
铜单质及其化合物在很多领域中都有重要的用途。请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下: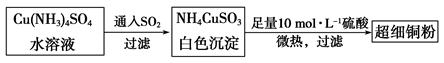
①NH4CuSO3中金属阳离子的核外电子排布式为______。N、O、S三种元素的第一电离能大小顺序为_______________________(填元素符号)。
②SO42-的空间构型为________。
(2)某学生用硫酸铜溶液与氨水做了一组实验,CuSO4溶液中加氨水生成蓝色沉淀,再加氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体,请解释加入乙醇后析出晶体的原因______________________;在该晶体中存在的化学键的种类有_____________。
(3)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图所示),a位置上Cl原子的杂化轨道类型为________。已知其中一种化合物的化学式为KCuCl3,则另一种化合物的化学式为____________。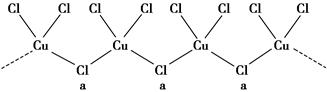
用晶体的X射线衍射法可以测得阿伏加德罗常数的值。对金属铜的测定得到以下结果:铜晶胞为面心立方最密堆积,边长为361 pm。又知铜的密度为9.00 g·cm-3,则铜原子的直径约为__________pm,阿伏加德罗常数的值为________[已知Ar(Cu)=63.6]。
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康
(1)含有较多______________的水称为硬水,硬水加热后产生沉淀的离子方程式为__________________________( 写出生成一种沉淀物的即可) 。
(2)下图为某饮用水厂从天然水制备纯净水(去离子水)的工艺流程示意图: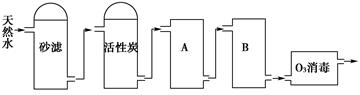
①活性炭的作用是__________________;O3消毒的优点是________________。
②A、B中放置的物质名称分别是:A__________________;B_______________。A、B中放置的物质是否可以互换?请说明原因________________________________________。
(3)通过施加一定压力使水分子通过半透膜而将大分子或离子截留, 从而获得纯净水的方法称为。电渗析法净化水时, 使离子通过半透膜的推动力是。
(4)检验蒸馏水的纯度时, 最简单易行的方法是测定水的 。
(5)某 城 市 用 水 中c(Ca2+)为1.0×10-3mol/L, c(Mg2+)为5.0×10-4mol/L,c(HCO3_)为8.0×10-4mol/L。如用药剂软化该1000L ,应加入Ca(OH) 2g , Na2CO 3 __________ g 。
(1)已知:O2 (g)= O2+ (g)+e- △H1=" +1175.7" kJ·mol-1
PtF6(g)+ e-= PtF6-(g)△H2=" -" 771.1 kJ·mol-1
O2+PtF6-(s)=O2+(g)+PtF6- (g)△H3="+482.2" kJ·mol-1
则反应:O2(g)+ PtF6 (g) = O2+PtF6(s)的△H="_____" kJ·mol-1。
如图为合成氨反应在使用相同的催化剂,不同温度和压强条件下进行反 应,初始时N2和H2的体积比为1:3时的平衡混合物中氨的体积分数: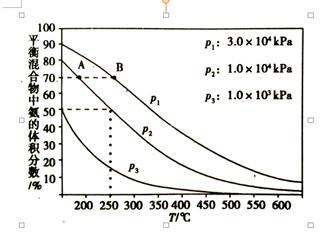
① 在一定的温度下,向体积不变的密闭容器中充入氮气和氢气发生上述反应,下列能说明反应达到平衡状态的是。
a.体系的压强保持不变b.混合气体的密度保持不变
c.N2和H2的体积比为1:3 d.混合气体的平均摩尔质量不变
②分别用vA(NH3)和vB(NH3)表示从反应开始到平衡状态A、B时的反应速率,则vA(NH3)vB(NH3)(填“>”、“<”或“=”),该反应的的平衡常数kAkB(填“>”、“<”或“=”),在250 ℃、1.0×104kPa下达到平衡,H2的转化率为%(计算结果保留小数点后一位);
(3)25℃时,将a mol NH4NO3溶于水,溶液呈酸性,原因(用离子方程式表示)。向该溶液中加入bL氨水后溶液呈中性,则所加氨水的浓度为mol/L(用含a、b的代数式表示,NH3·H2O的电离平衡常数为Kb=2×10-5)
(4)如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。电镀一段时间后,装置Ⅰ中溶液的pH (填“变大”、“变小”或“不变”),a极电极反应方程式为;若电镀结束后,发现装置Ⅱ中阴极质量变化了25.6g(溶液中硫酸铜有剩余),则装置Ⅰ中理论上消耗甲烷L(标准状况下)。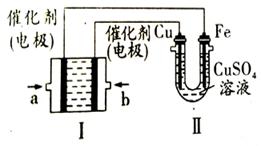
CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下: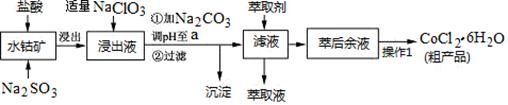
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
| 开始沉淀 |
2.7 |
7.6 |
7.6 |
4.0 |
7.7 |
| 完全沉淀 |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式________________________。
(2)写出NaClO3发生反应的主要离子方程式_____________________________;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式_______________。
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为。
(4)“操作1”中包含3个基本实验操作,它们依次是_________、__________和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是_________;其使用的最佳pH范围是________________。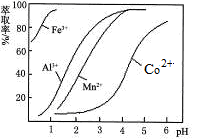
A.2.0~2.5B.3.0~3.5C.4.0~4.5D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是_____________________。(答一条即可)