(本题共12分)CO的应用和治理是当今社会的热点问题。
29、CO能导致镍系催化剂中毒,工业上常用SO2除去原料气中少量CO,生成物为固体S和CO2。
写出该反应的化学方程式为 。
30、上述反应中,每减少2.24L气体(标准状况下),转移电子数为 。
CO工业上可用于高炉炼铁,发生如下反应: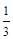 Fe2O3(s) + CO(g)
Fe2O3(s) + CO(g)
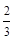 Fe(s) + CO2(g),
Fe(s) + CO2(g),
已知该反应在不同温度下的平衡常数如下表:
| 温度/℃ |
1000 |
1150 |
1300 |
| 平衡常数 |
4.0 |
3.7 |
3.5 |
31、下列说法不正确的是 (选填序号)
a.该反应是一个放热反应
b.该反应的平衡常数表达式是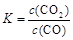
c.其他条件不变,向平衡体系充入CO2气体,K值减小
d.当K值等于1时,反应达到平衡
32、欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是 (选填序号)
a.及时吸收或移出CO2 b.增大反应体系的压强
c.用更高效的催化剂 d.粉碎矿石,增大接触面积
高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g) + 2H2(g) CH3OH(g) + Q
CH3OH(g) + Q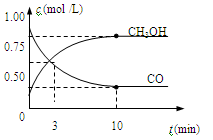
33、从上图可以看出,反应开始到平衡,反应速率v(H2) 。
。
34、甲醇氧化可生成甲酸,能使0.1mol/L的甲酸溶液的电离度与pH值都增大的是 (选填序号)。 a.加水稀释 b.加入少量甲酸钠固体
a.加水稀释 b.加入少量甲酸钠固体
c.通氯化氢 d.加入少量苛性钠固体
(8分)按照下表左边的实验操作,可以观察到表中右边的实验现象。请从“实验现象”栏中选择正确选项的字母代号填入对应的空格中。
| 实验操作 |
答案 |
实验现象 |
||||
| (1) 将KSCN溶液滴入FeCl3溶液中 |
|
|||||
| (2) 将C2H4通入酸性KMnO4溶液中 |
||||||
| (3) 将浓HNO3滴入蛋白质溶液中,微热 |
||||||
| (4) 将葡萄糖溶液滴入到新制的Cu(OH)2中,加热 |
甲、乙、丙、丁四种单质在点燃条件下两两化合生成X、Y、Z、W四种化合物,转化关系如图所示,又知:
①甲、乙、丙均为前三周期元素的单质,常温下均为气态,
丁是日常生活中的一种常见金属;
②常温下,X是无色液体,Y是黑色固体;
③丙在乙中燃烧发出苍白色的火焰,丁在乙中燃烧生成棕黄色
的烟,W的水溶液呈黄色。
回答下列问题:
(1) 写出下列物质的化学式: X W
(2)将乙单质通入紫色石蕊试液中,看到的现象是 。
(3)写出丁单质与Z的水溶液反应的化学方程式 。
(8分)下表列出了①~⑥六种元素在元素周期表中的位置。
 族 族周期 |
IA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
请回答下列问题:
(1) ①、②、③三种元素相比较,非金属性最强的是(填写元素符号);
(2) 元素②和⑥的氢化物中,稳定性较强的是(填氢化物的分子式);
(3) ①的最高价氧化物对应的水化物的化学式为 ;
(4)④、⑤两种元素的最高价氧化物对应的水化物在溶液中相互反应的离子方程式是
。
(8分)为提高人体素质, 避免人体缺碘影响正常的生命活动,我国早已采取食盐加碘措施。据报道, 人从食物中摄取碘后碘便在甲状腺中积存下来, 通过一系列化学反应可形成甲状腺素。甲状腺素的结构如下图,回答下列问题: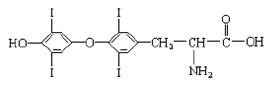
(1)甲状腺素由________种元素组成;
(2)“加碘食盐”中的碘元素以碘酸钾(KIO3 )的形式存在 , KIO3中碘的化合价是,我们用稀盐酸和淀粉KI试纸可以检验食盐中碘酸钾的存在,实验现象是。
(3)在“加碘食盐”包装袋上有“烹调时,待食品熟后加入碘盐” 文字说明,由此可推测碘酸钾在受热时容易。
(4分) 将钠在空气中燃烧,产物的化学式为 ;某无色气体与空气接触后,气体的颜色由无色变成红棕色,则原气体为 。