(8分)为提高人体素质, 避免人体缺碘影响正常的生命活动,我国早已采取食盐加碘措施。据报道, 人从食物中摄取碘后碘便在甲状腺中积存下来, 通过一系列化学反应可形成甲状腺素。甲状腺素的结构如下图,回答下列问题: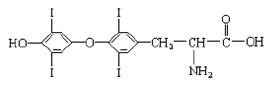
(1)甲状腺素由________种元素组成;
(2)“加碘食盐”中的碘元素以碘酸钾(KIO3 )的形式存在 , KIO3中碘的化合价是 ,我们用稀盐酸和淀粉KI试纸可以检验食盐中碘酸钾的存在,实验现象是 。
(3)在“加碘食盐”包装袋上有“烹调时,待食品熟后加入碘盐” 文字说明,由此可推测碘酸钾在受热时容易 。
A、B、C和D等4种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C。
(1)B在周期表中的位置第周期,第族;
(2)A、B形成的化合物的电子式;
(3)C的元素名称________,C的最高价氧化物的 化学式;
化学式;
(4) D的最高价氧化物对应的水化物的化学式。
某铁的氧化物粉末可能含有FeO、Fe2O3中的一种或两种。某兴趣小组同学利用以下装置测定铁的氧化物的组成,请回答下列问题:
(已知 )
)
(1)装置甲的作用是。
(2)装置丁中的实验现象是。
(3)若丙中铁 的氧化物的化学式为FexOy,则丙中反应的化学方程式为。若丙中铁的氧化物质量为3.92g,且完全反应,丁中生成沉淀的质量为13.79g,试确定该氧化物中x : y=,该固体粉末的组成为。
的氧化物的化学式为FexOy,则丙中反应的化学方程式为。若丙中铁的氧化物质量为3.92g,且完全反应,丁中生成沉淀的质量为13.79g,试确定该氧化物中x : y=,该固体粉末的组成为。
1984年,地坛医院的前身北京第一传染病医院研制成功能迅速杀灭各类肝炎病毒的消毒液,经北京市卫生局组织专家鉴定,授予应用成果 二等奖,定名为“84”肝炎洗消液,后更名为“84消毒液”。
二等奖,定名为“84”肝炎洗消液,后更名为“84消毒液”。
(1) “84消毒液”的有效成分是NaClO。其工业制法是利用Cl2与NaOH反应得到,请写出该反应的化 学反应方程式_______________________;另外,电解NaCl溶液可直接制备84消毒液,通电时氯气被溶液完全吸收,请写出电解NaCl溶液的化学反应方程式___________。
学反应方程式_______________________;另外,电解NaCl溶液可直接制备84消毒液,通电时氯气被溶液完全吸收,请写出电解NaCl溶液的化学反应方程式___________。
(2)“84消毒液”可用于公共场所卫生洁具清理和染 色白毛巾的处理,但不宜与其他洗涤液混用,尤其不能与洁厕灵混合,混合后容易发生的离子反应方程式是
色白毛巾的处理,但不宜与其他洗涤液混用,尤其不能与洁厕灵混合,混合后容易发生的离子反应方程式是
___________________________。
(3)“84消毒液”本品在空气中露置一段时间会失效,试解释失效的主要原因
__ _________________
_________________ ___________________________________
___________________________________ ______________。
______________。
“材料”的发现和使用往往会极大 地推动生产、生活的发展,一些材料的出现甚至具有里程碑式划时代的意义。请你回答以下问题:
地推动生产、生活的发展,一些材料的出现甚至具有里程碑式划时代的意义。请你回答以下问题:
(1)无机非金属材料。高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾
引起计算机的一场“革命”。这种材料可以按下列方法制备: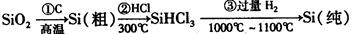
①写出步骤①的化学方程式 。
。
②步骤②经过冷凝得到的SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点57.6℃)和HCl(沸点—84.7℃),提纯SiHCl3的主要化学操作的名称是;SiHCl3和SiCl4一样遇水可发生剧烈水解,已知SiHCl3水解会生成两种气态产物,请写出其水解的化学方程式。
③请写出二氧化硅与氢氟酸反应的化学方程式。
(2)磁性材料。这种材料一般含有铁元素,铁是用途最为广泛的金属,也较为活泼,所以从它的使用开始就不断实施着对它的防护。最常见的铁制品腐蚀就是电化学腐蚀,请出最为普遍的电化学腐蚀的负极反应式。
(3)激光材料。我国是激光技术先进的国家,红宝石(Al2O3)是最早用于产生激光的材料,它是一种两性氧化物,请用离子方程式加以说明:,。
(4)纳米材料。胶体是一种物质以“纳米”颗粒的形式分散到另一种物质里形成的分散系,胶体粒子的直经大约是,三氯化铁溶液可以加速伤口止血,请简述原因
。
(5)高分子材料。可以分成无机高分子材料和有机高分子材料。一种新型高效净水剂[AlFe(OH)nCl6—n]m就属于无机高分子材料,广泛应用于生活用水和工业污水处理,其中铁元素的化合价为。
孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。以孔雀石为原料可制备CuSO4·5H2O及纳米材料G,步骤如下: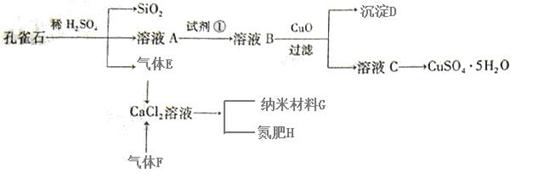
请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①最佳为(填代号)。
a.KMnO4b.(NH4)2S c.H2O2
沉淀D中除了过量的CuO外,还存在另一种固体,其化学式为。加入CuO作用是。
(2)加入试剂①后,溶液中反应的离子方程式,并用单线桥标出电子转移的方向和数目:
(3)制备纳米材料G时,应向CaCl2溶液中先通入(或先加入)(填化学式)。写出该反应的化学方程式。
(4)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4标准溶液应用;取A溶液稀释一定倍数后,用KMnO4标准溶液滴定,终点现象为。