研究氢气、一氧化碳和二氧化碳具有重要意义.
(1)在汽车“催化转化器”内发生反应的化学方程式是:2NO+2CO N2+2CO2.某化学探究小组的同学为探究温度、催化剂的比表面积对化学反应速率的影响,设计了下列三组实验.
N2+2CO2.某化学探究小组的同学为探究温度、催化剂的比表面积对化学反应速率的影响,设计了下列三组实验.
| 实验编号 |
T/℃ |
NO初始浓度/g•L﹣1 |
CO初始浓度/g•L﹣1 |
催化剂的比表面积/m2•g﹣1 |
| Ⅰ |
280 |
0.036 |
0.162 |
82 |
| Ⅱ |
280 |
0.036 |
0.162 |
124 |
| Ⅲ |
350 |
0.036 |
0.162 |
124 |
(1)分析上表中实验数据,回答下列问题:探究温度对化学反应速率影响的实验是 (填写实验编号);研究催化剂的表面积对化学反应速率影响的实验是 (填写实验编号).
(2)在300℃、70MPa下,使用催化剂可由氢气和二氧化碳合成乙醇,同时生成水,写出反应的化学方程式 .
(3)燃料燃烧时产生的热量不同.已知在某温度下各种燃料燃烧时产生的热量见下表:
| 燃料 |
质量/g |
产物 |
产生的热量/KJ |
| 氢气 |
2 |
水蒸气 |
241.8 |
| 甲烷 |
16 |
二氧化碳气体和水蒸气 |
890.3 |
| 乙醇 |
46 |
二氧化碳气体和水蒸气 |
1367 |
分析表中数据,燃烧单位质量的上述燃料产生的热量由多到少的顺序是 (用化学式表示).
以电解食盐水为基础制取氯气、氢氧化钠等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不符合电解要求,因此必须经过精制。以粗盐为原料的“氯碱工业”流程如下: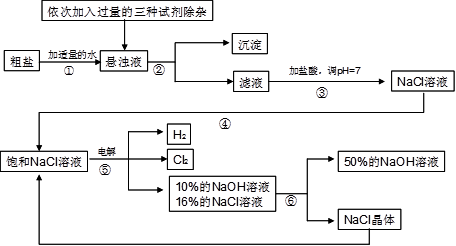
回答下列问题:
(1)氯气、氢氧化钠在工业上有广泛的用途。下列关于氢氧化钠的描述中,错误的是。
| A.能去除油污,可做厨房清洁剂 | B.易溶于水,溶解时放出大量的热 |
| C.水溶液能使石蕊溶液变红 | D.可用作某些气体的干燥剂 |
(2)操作②的名称是,操作④的名称是。
(3)操作①②间除杂质时所加的三种试剂是NaOH溶液、Na2CO3溶液、BaCl2溶液(均过量),其顺序要求是:Na2CO3溶液必须在BaCl2溶液之(填“前”或“后”)加入。有同学提出用溶液代替BaCl2溶液可达到同样的目的。
(4)电解饱和NaCl溶液的化学方程式是。
(5)该流程中可以循环利用的物质是。
在化学课上,甲同学将燃烧的钠迅速伸入到盛有CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上附粘附着白色物质。
【提出问题】黑色颗粒和白色物质是什么?
【进行猜想】甲认为黑色颗粒是,白色物质可能是Na2O或;
乙同学还认为白色物质是氢氧化钠。
甲同学立刻认为乙同学的猜想是错误的,其理由是。
【查阅资料】氧化钠为白色粉末,溶于水生成氢氧化钠:Na2O + H2O = 2NaOH
【实验探究】甲同学对白色物质进行实验探究。
| 实验方案 |
实验操作 |
实验现象 |
结 论 |
| 方案1 |
取样品少量于试管中,加入适量水,振荡,样品 全部溶于水,向其中加入无色酚酞试液 |
溶液变成红色 |
白色物质 为Na2O |
| 方案2 |
①取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 |
出现白色沉淀 |
白色物质 是 |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 |
无明显现象 |
【反思评价】丙同学认为方案1得到的结论不正确,理由是。
【得出结论】钠在二氧化碳中燃烧的化学方程式为。
通过以上探究,你还能获得哪些结论,请写出两条。(答对本小题将奖励4分,但全卷总分不超过60分)
②,
② 。
某兴趣小组对4瓶无色溶液Na2CO3溶液、NaOH溶液、Ca(OH)2溶液、稀盐酸进行鉴别。
甲同学利用紫色石蕊试液进行鉴别
| 实验步骤 |
现象与结论 |
| ①用4支试管,分别取少量的不同溶液,各滴加紫色石蕊试液 |
1支试管中出现红色,则原溶液是 |
| ②另用3支试管,分别取少量未确定的溶液,各滴加步骤①检验出的溶液。 |
1支试管中有气泡产生,则原溶液是Na2CO3溶液 |
| ③另用2支试管,分别取少量未确定的溶液, |
1支试管中有白色沉淀析出,则原溶液是Ca(OH)2溶液,1支试管中无现象,则原溶液是NaOH溶液 |
乙同学不用其他试剂进行鉴别
| 同学 |
实验操作 |
现象 |
结论 |
| 小敏 |
用3支试管分别取少量不同的溶液,各滴加剩余的另一种溶液 |
1支试管中有气泡产生,其余2支试管中无现象 |
所滴加的溶液是稀盐酸 |
| 小红 |
1支试管中有白色沉淀析出,其余2支试管中无现象 |
所滴加的溶液是Na2CO3溶液 |
|
| 小刚 |
…… |
…… |
乙组同学经过交流后发现,根据小红与小敏的实验现象, 的结论是错误的。如果小刚所滴加的是NaOH溶液,则他的实验现象是
小明和小丽对蓝色的硫酸铜溶液很感兴趣,他们设计如下实验探究其相关性质并对反应后所得物质进行分析和处理。
⑴我能写出其中两个不同基本反应类型的化学方程式:①________;②________。
⑵实验完毕,小明和小丽各自将三个反应所得到的物质混合、过滤,得到甲、乙两种无色溶液。小明取少量甲溶液于试管中,滴加紫色石蕊溶液,试管中溶液呈紫色。则甲溶液中一定含有的溶质是________(填化学式,下同),可能含有的溶质是________或________。
小丽对乙溶液进行了探究,发现乙溶液中含有氯化钾、硫酸钾和氢氧化钾。她说:我还能设计如下实验,在步骤①、②、③每次用一种无色溶液除去乙溶液中一种物质,且每步均有白色沉淀生成,最后得到纯净的硝酸钾晶体。
在步骤⑦中进行的操作是________,步骤③、⑥所加物质分别是________、________ (填化学式,下同),固体E的成分有________。
某无色溶液可能由盐酸、氢氧化钠溶液、氯化钠溶液、碳酸钠溶液中的一种或几种混合而成。为探究其组成,小华同学进行了如下实验:
Ⅰ、取适量样品放入试管中,滴加酚酞溶液,溶液变成红色。再向试管中逐滴加入过量的氢氧化钙溶液,观察到有沉淀产生。过滤,所得滤液为红色。
(1)由实验Ⅰ中的现象可推断出样品中一定含有的物质是________(写化学式,下同),一定不含有的物质是________;为了进一步探究样品中可能含有的物质是否存在,小华继续进行了如下实验:
Ⅱ、取适量实验Ⅰ所得的红色滤液放入试管中,滴加过量的稀硝酸,溶液变无色。再向试管中逐滴加入适量的硝酸银溶液至恰好完全反应,观察到有白色沉淀生成。过滤,所得滤液为无色。
Ⅲ、从稀硫酸、氢氧化钡溶液、氯化钡溶液、硝酸钾溶液中选择一种试剂,代替实验Ⅰ中的氢氧化钙溶液进行实验,其余的试剂及操作与实验Ⅰ的均相同。
通过实验Ⅱ和实验Ⅲ,小华得出结论:样品中可能含有的物质确实存在。
(2)实验Ⅱ所得无色滤液中,除酚酞以外,还含有的溶质为_____;
(3)实验Ⅲ中代替氢氧化钙溶液的试剂是________溶液,可观察到的现象为________。